<화합물의 명명법 대략적 틀>
*기본적 형태
한글 : [2번째 원소]화 [1번째 원소]
영어 : [1번째 원소] [2번째 원소]ide
1. 이온결합 화합물
-유형1 금속 이성분 이온결합 화합물 : 그대로 쓴다 (*단 산소, 염소는 산소화/염소화 대신 산화/염화)
-유형2 금속 이성분 이온결합 화합물 : 유형2 금속의 전하량을 로마자로 표시한다
-다원자 이온이 포함된다면? 뭐라 불리는지 다 외워야 한다('-화' 가 아닐 수도 있음) & 산소 개수에 따른 명명법 존재
2. 공유결합 화합물
-이성분 공유결합 화합물 : 숫자 접두사를 추가해야 한다 (*단 1번째 원소 개수가 1개면 표시하지 않는다)
-산 : 산소가 없으면 [분자명+수소산]
산소가 있으면 [음이온명+산], 영어의 경우 ate - ic acid, ite - ous acid
| 이온결합 화합물 | 유형1 금속 유형2 금속 *다원자 이온은 다 암기 |
| 공유결합 화합물 (분자) | |
| 산 (H+ 포함) | 산소가 없는 산 산소가 있는 산 |
이온결합 화합물 명명법
[1] 이성분 이온결합 화합물 - 유형1 금속
-한 종류의 양이온만을 가지는 금속
*명명법
한글 : (음이온 원소)화 (양이온 금속)
*염소, 산소는 소 생략
영어 : (양이온 금속) (음이온 원소 어근)ide
H- hydride 수소화
F- fluoride 플루오린화
Cl- chloride 염화
Br- 브로민화 bromide
I- 아이오딘화 iodide
O2- 산화 oxide
S2- 황화 sulfide
N3- nitride 질소화
P3- 인화 phosphide
*유형1에 해당하는 금속
(1종류의 양이온만을 가지는 금속)

1A 알칼리 금속 - 리튬(Li), 소듐(Na), 포타슘(K), 루비듐(Rb), 세슘(Cs), 랑슘(Fr)
2A 알칼리 토금속 - 베릴륨(Be), 마그네슘(Mg), 칼슘(Ca), 스트론튬(Sr), 바륨(Ba), 라듐(Ra)
Al(3+만), Ag(거의 1+만), Zn(거의 2+만)
Cd 2+, Ga 3+
*예시
CuCl 염화구리
HgO 산화수은
CsF 플루오린화 세슘 cesium fluoride
AlCl3 염화알루미늄 aluminnum chloride
LiH 수소화 리튬 lithium hydride
아이오딘화 포타슘 KI potassium iodide
산화 칼슘 CaO calcium oxide
브로민화 갈륨 GaBr3
CaCl2 염화칼슘 calcium chloride
Al2O3 산화 알루미늄 alluminnum oxide
아이오딘화 갈륨 GaI3
[2] 이성분 이온결합 화합물 - 유형2 금속
-여러 종류의 양이온을 가지는 금속
*명명법
한글 : (음이온 원소)화 (양이온 금속) (로마숫자)
영어 : (양이온 금속) (로마숫자) (음이온 원소 어근)ide
*유형2에 해당하는 금속
(여러 종류의 양이온을 가지는 금속)

Fe Co Mn Cr 2+, 3+
Cu 1+, 2+
Sn Pb 2+ 4+
Hg 2+ (II) , Hg2 2+ (I)
*예시
HgO 산화수은(II) Hg oxide(II)
Fe2O3 산화철(III) iron oxide(III)
MnO2 이산화망가니즈
CuCl 염화구리(I)
염화 납(II) PbCl2
CoBr2 브로민화 코발트(II)
염화 크로뮴(III) CrCl3
Nb2O2 산화 나이오븀(V) Niobium(V) oxide
플루오린화 바나듐(V) VF5
*다원자이온이 있는 경우
이온결합물질뿐만 아니라, 공유결합물질, 산 명명법에도 적용됨
-다원자 이온명 외우기 + 약간의 산소 명명 규칙
*명명법
기본적으로 위의 규칙들을 따르나,
금속이 다원자 이온이면 꼭 -화 -- 형태가 아닐 수도 있음
산소 명명 규칙
과 -산 per -ate
-산 -ate
아 -산 -ite
하이포 -산 hypo -ite
*다원자이온 이름 암기
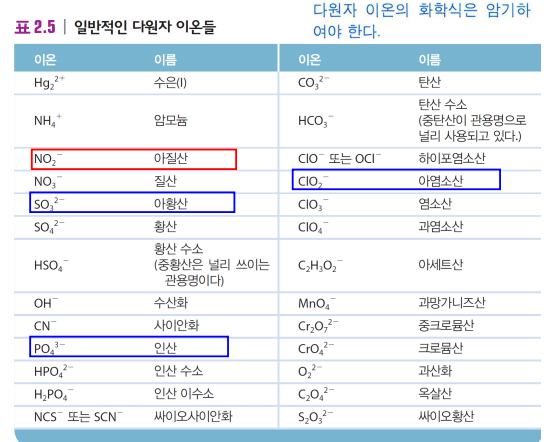
*예시
Na2SO4 황산소듐
KH2PO4 인산이수소 포타슘
Fe(NO3)3 질산 철(III)
Mn(OH)2 수산화 망가니즈(II)
Na2SO3 아황산 소듐
Na2CO3 탄산 소듐
탄산수소소듐 NaHCO3
과염소산 세슘 CsClO4
하이포아염소산 소듐 NaOCl
셀레늄산 소듐 NaSeO4
브로민산 포타슘 KBrO3
Ti(NO3)4 질산 타이타늄(VI) TItanium(VI) nitrate
이성분 공유결합 화합물(분자) 명명법
*명명법
(접두사 두번째 원소)화 (접두사 첫 번째 원소)
*접두사 일-이-삼- 표기, 단 뒤에꺼가 1이면 ㄴㄴ
(접두사 첫번째 원소) (접두사 두번째 원소)ide
*접두사 표기, 단 첫번째 원소가 1이면 ㄴㄴ
1 mono- / 2 di- / 3 tri- / 4 tetra- / 5 penta- / 6 hexa- / 7 hepta- / 8 octa- / 9 nona- / 10 deca-
*일부는 체계명 대신 일반명 (물, 암모니아)
*예시
PCl5 오염화인 phosphorous pentachloride
PCl3 삼염화인 phosphorous trichloride
SO2 이산화황 sulfur dioxide
육플루오린화 황 SF6
삼산화 황 SO3
이산화탄소 CO2
P4O10 십산화인 tetraphosphorous decaoxide
이플루오린화 이산소 O2F2
산 명명법
대부분 H+와 음이온의 결합
[1] 산소가 없는 산
*명명법
한글 : (음이온 원소)화 수소산
*마치 유형1 이온결합 화합물에 산만 추가한 형태이다
영어 : hydro(음이온명)ic acid
*예시
HCl 수용액 : 염화수소산 hydrochloric acid
HCN 수용액 : 사이안화 수소산 hydrocyanic acid
HF 플루오린화 수소산
HBr 브로민화 수소산
HI 아이오딘화수소산
[2] 산소가 있는 산
*명명법
(음이온 원소)
~산산 하면 이상해서 그런지..? 산조차 안 붙음
(음이온 ate형)ic acid ex. H2SO4 sulfate → suluric acid
(음이온 ite형)ous acid ex. H2SO3 sulfite → sulfurous acid
한글에서 수소 없듯이 얘네도 hydro 없음
*예시
H3PO4 - 인산 phoshoric acid
HNO3 질산
HNO2 - 아질산 nitrous acid
H2SO4 황산
H2SO3 아황산
HClO4 과염소산 perchlorate니까
HClO3 염소산 chlorate니까
HClO2 아염소산 chlorite니까
HClO 하이포아염소산 hypchlorite니까
HC2H3O2 아세트산
'일반화학 > 화학 중요 개념' 카테고리의 다른 글
| 산화-환원 반응식의 균형 맞추기 (0) | 2023.05.08 |
|---|---|
| <일반 화학> 침전반응 - 염 용해도 예측 규칙 (0) | 2023.05.08 |


댓글