영상강의
유기화학이란?
탄소(C)를 함유한 분자의 반응=전자의 흐름=결합의 깨짐과 생성
그러니 반응을 이해해야 한다.
열역학 vs 반응속도론
| 열역학(Theromodynamics) | 반응속도론(Kinetics) |
| 반응이 자발적으로 일어날 것이냐? | 반응이 얼마나 빨리 일어나는가? |
| △G △S계 & △S주위 △S계 & △H계 가 결정함 |
활성화 에너지 Ea가 결정함 |
| 처음상태와 나중상태가 결정 | 전이상태가 중요 |
둘은 무관하다. 구별할 수 있어야 한다!

ex. 다이아몬드가 흑연으로 바뀌는 과정은 자발적이지만, 매우 느림
즉, 열역학적으로 선호되지만, 반응속도론에서 불리함
열역학(thermodynamics)
1,2,3은 결국 똑같은 이야기이다.
(1) 우주의 엔트로피(계와 주위의 엔트로피 총합)가 증가해야 반응이 자발적이다
"열역학 제 2법칙"
우주의 엔트로피( △S우주 = △S계 + △S주위)가 증가해야 반응이 자발적이다
| 주위의 엔트로피 변화 △S주위 = - △H계/T |
계의 엔트로피 변화 △S계 |
| 계에서 방출한 열이, 주위의 무질서한 운동을 증가시킴 ★똑같은 열이 방출되어도, 주위의 온도가 낮을 때 주위의 엔트로피가 더 크게 변화한다 (-△H계/T인 이유) |
분자수가 많아지거나, 고리가 선형이 되면 무질서해짐 |
(2) 계의 엔트로피, 계의 엔탈피(주위의 엔트로피)가 반응의 자발성을 결정한다
즉 엔트로피 S계, 엔탈피 H계가 반응의 자발성을 결정
△H가 음수(열을 방출), △S가 양수(무질서해짐)일수록 자발적
| 주위의 엔트로피 → 엔탈피 △S주위 = - △H계/T |
계의 엔트로피 △S계 |
| 결합에 의한 열의 출입 | 무질서의 척도 |
| 결합이 깨지려면 에너지가 투입된다. 결합이 생성되면 에너지가 방출된다. *강한 결합일수록 방출E=투입E ↑ >> 어떤 결합이 깨지고 생기는지가 엔탈피를 결정한다 반응에 의해 결합이 깨지고, 새로 생성되며 total 에너지가 필요한지(흡열), 방출되는지(발열) 알아야 함 |
분자수가 더 많아지면! 고리보다 선형 분자가! 무질서하다 |
| ★똑같은 열이 방출되어도, 주위의 온도가 낮을 때 주위의 엔트로피가 더 크게 변화한다 (-△H계/T인 이유) |
※엔탈피는 반응에서 깨지고 생기는 결합이 결정한다
강한 결합일수록 깨기 위해 많은 에너지가 필요하고, 생성될 때 많은 에너지를 방출한다



***엔탈피와 흡열/발열
흡열(endothermic) 반응은 △H>0
발열(exothermic) 반응은 △H<0
***(헷갈릴 수 있는 개념) 발열반응과 자발성의 차이
발열반응은 △H계<0일 뿐이다.
발열(exothermic)반응이라고 무조건 자발적(exergonic)인게 아니다!!!!!
자발적이려면 △G<0이어야 한다.
자발성인지 알기 위해서는 △S까지 따져봐야 한다!
※엔트로피는 무질서한 정도가 결정한다
분자수가 많을수록 엔트로피가 증가한다

고리분자보다 선형분자가 무질서하다
(3) 깁스 에너지가 음수여야 반응이 자발적이다
깁스 에너지 G: 자발성(우주의 엔트로피)의 척도.
주위의 엔트로피와 계의 엔트로피를 모두 아우르는 개념
즉 계의 엔트로피, 계의 엔탈피를 모두 아우르는 개념
△G = △H계 - T△S계
△G<0이면 자발적이다.
△G<0이면 △S우주>0이기 때문.
△G/T = △H계/T - △S계 = -△S우주
※자발성과 온도
같은 열이 방출되어도, 주위의 온도가 낮을수록 △S주위가 클 것이다. (쉽게 영향을 받음)
따라서 같은 반응도, 온도에 따라 자발성이 달라질 수 있다.
물론 항상 자발적이거나 항상 비자발적인 반응도 있다.
△S우주, 즉 △S계, △S주위 로 보는 자발성과 온도의 관계
△S계>0 **무질서해짐♡ △S주위>0 **발열♡ |
모든 온도에서 자발적 |
△S계<0 **질서 △S주위<0 **흡열 |
모든 온도에서 비자발적 (역방향이 자발적) |
| △S계>0 **무질서해짐♡ △S주위<0 **흡열 |
△S계가 △S주위보다 영향력 있을 때만 자발적 - T가 높을 때 ex. 100도씨 이상에서 물이 수증기(흡열) |
| △S계<0 **질서 △S주위>0 **발열♡ |
△S주위가 △S계보다 영향력 있을 때만 자발적 - T가 낮을 때 ex. 0도씨 이하에서 물이 얼음으로(발열) |
△G, 즉 △S계, △H계 로 보는 자발성과 온도의 관계
| △H계<0 △S계>0 발열적이고 무질서하기까지... |
모든 온도에서 자발적 |
| △H계>0 △S계<0 아놔 흡열에다가 질서정연해지자나;; |
모든 온도에서 비자발적 |
| △H계>0 **흡열 △S계>0 **무질서해짐 |
높은 온도에서 자발적 (무질서함으로 발열성이 아닌 걸 커버칠 수 있는 온도 이미 높은 온도라 좀 빼앗겨도 됨) (반대로 말하자면, 발열성이 중요한 온도라 발열인 역반응이 자발적이다) |
| △H계<0 **발열 △S계<0 **질서해짐 |
낮은 온도에서 자발적 (발열성이 중요한 추진력) |
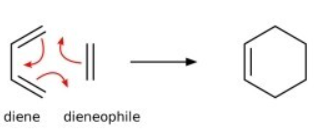
적용해보자!

이 반응은
1) △S<0
분자수가 줄고, 고리분자가 되어 무질서도가 낮아진다.
2) △H<0
2개의 파이결합이 깨지고(E 흡수), 2개의 시그마 결합이 생긴다(E방출).
파이결합이 시그마 결합보다 약하니, 방출되는 열이 더 크다
>>> △G = △H계 - T△S계 <0이려면, 이 반응은 저온에서 자발적이게 될 것이다.
반응속도론 (Kinetics)
속도는 자발성과 무관하다
유효한 충돌을 많이 할수록 반응 속도가 빨라진다.
| 반응물 농도 | 활성화 에너지 ★ | 온도 | 분자배향 등 | 촉매 |
| 농도가 높으면 충돌수도 많아진다 | 유효충돌, 즉 반응을 일으키기 위해 충돌할 때 특정 에너지 값을 넘어야 한다 | 유효충돌 분율을 높인다. 활성화 에너지 이상인 분자 비율이 커짐 |
유효충돌을 위해 특정 배향을 가져야 한다 | 활성화 에너지를 낮춰 유효충돌분율을 높인다 |
 |
 |
 |
※ Transition state(전이상태) vs Intermediate(중간체)
활성화에너지를 결정하는 건 전이상태.
아주 잠깐 생겨서 분리할 수 없음
반면 중간체는 분리 가능

※헷갈릴 수 있는 개념※ 그래프로 보는 자발성 vs 반응속도

자발성은 처음 상태와 나중상태의 G차이, 즉 △G가 결정
*자발성에 영향을 주는 한 요인인 △H는 발열반응인지, 흡열반응인지와 관련 있음.
반응 속도는 활성화 에너지가 결정함
(즉, 처음/나중 상태가 결정하지 않음)

이 반응은 활성화 에너지를 비교했을 때 핑크가 반응속도가 빠름
열역학(자발성)은 파랑이 유리함 (물론 정확히 하려면 계의 엔트로피까지 고려해야 하나, 엔탈피만 비교했을 때)
'유기화학' 카테고리의 다른 글
| [유기 화학] 2. 산과 염기 (Acids and Bases) (0) | 2024.07.11 |
|---|---|
| [유기 화학] 1-3. 공명(resonance) (0) | 2024.06.29 |
| [유기 화학] 1-2. 작용기(Functional Group) (0) | 2024.06.28 |
| [유기화학] 1-1. 골격구조식(bond-line structure), wedge&dash (0) | 2024.06.28 |
| [유기 화학] 0-1. 공유결합의 이해 - 혼성오비탈, 극성, 분자 간 힘 등 (0) | 2024.06.27 |




댓글