영상 강의
본격적인 유기화학 공부 전, 알아야 하는 개념들을 정리했습니다.
유기화학이란?
탄소(C)를 함유한 분자의 반응=전자의 흐름=결합의 깨짐과 생성
그러니 공유결합을 이해해야 한다.
공유결합 Covalent bond & 에너지
공유결합이 생기는 이유는 에너지가 낮아져서이다.

원자 간 거리에 따른 에너지
<핵-핵, 전자-전자 반발력 & 핵-전자 인력>
-가까워질수록 인력에 의해 에너지가 낮아지다가
-너무 가까우면 반발력에 의해 에너지가 높아짐
가장 에너지가 낮아지는 지점에서 공유결합이 형성 됨
1) 그 때가 거리가 bond length
2) 결합 전과 비교했을 때 방출되는 E, 즉 얼마나 에너지가 낮아졌는지가 bond strength이다.
역으로 결합을 깨려면 그 에너지 만큼 가해야 함
오비탈과 공유 결합
간단하게 중요한 개념만 짚고 넘어가겠다. 자세한 내용은 밑의 링크에!
*원자의 오비탈은 아래 글을 참고
<일반 화학> 7장- 원자 구조와 주기성
줌달의 일반화학 10판 정리 흐름 check -물질과 파동은 사실 하나였다 -이를 기반으로 원자 모형(오비탈)을 세웠다 -오비탈에 대해 알아보자 -오비탈로 설명되는 원자의 주기적 성질에 대해 알아보
pharmguide.tistory.com
*공유결합과 오비탈은 아래 글을 참고
<일반 화학> 8장 후반~9장- 공유 결합: 오비탈
공유 결합 화합물 - 구조 모형 VBT 모델 (원자가 결합 이론) : 루이스 구조+VSEPR+혼성화 이론(양자 역학) 편재된 전자 모형 (LE model) 1. 루이스 구조 - 원자가 전자 배치 설명 전자가 핵과 핵 사이에 편
pharmguide.tistory.com
1. 혼성 오비탈 이론 & VSEPR 모델
그냥 원자의 s오비탈, p오비탈이 그대로 공유결합에 참여한다면,
CH4의 정사면체 구조 등.. 많은 것들이 설명될 수 없다.
원자의 오비탈은 혼성화를 거친 후 공유결합에 참여한다고 생각해야 편하다.

오비탈의 혼성을 알려면 Steric Number를 파악해야 한다
Steric Number = 공유전자쌍 + 비공유전자쌍 수 를 더한다.
단, 다중결합은 1개로 취급한다.
Steric Number에 따라
| SN=4 sp3 혼성화 |
SN=3 sp2 혼성화 + p |
SN=2 sp 혼성화 + 2p |
| 1s, 3p가 합쳐져 4개의 동등한 sp3 오비탈을 만듦 | 1s, 2p가 합쳐져 3개의 동등한 sp3 오비탈, 남은 1개의 p오비탈 | 1s, 1p가 합쳐져 2개의 동등한 sp 오비탈, 남은 2개의 p오비탈 |
| sp3 sp3 sp3 sp3 | sp2 sp2 sp2 p | sp sp p p |
| 약 109.5도 | 약 120도 | 180도 |
| 정사면체 (tetrahedral) trigonal pyramidal bent |
평면삼각형 (trigonal planar) bent |
선형 (linear) |
| ex. 4개의 단일결합 CH4 3단일 1비공유 NH3 2단일 2비공유 H2O |
ex. 1이중 2단일 C2H4 1이중 2비공유 O2 3단일 BH3 |
ex. 1삼중 1단일 C2H2 2이중 CO2 2단일 BeH2 |
이러한 전자쌍들은 서로 최대한 멀어지려 하기 때문에 (전자의 반발력)
정사면체, 평면삼각형, 선형 등의 VSEPR 모델 구조를 따른다
주의해야 할 것은, 분자의 '구조'에는 비공유 전자쌍이 포함되지 않는다!
그래서 같은 sp3 혼성화이지만,
CH4는 tetragedral, NH3는 trigonal pyramidal이다.
+자잘한 디테일
비공유전자쌍은 1개 원자에, 공유전자쌍은 여러 원자에 걸쳐 있기 때문에
비공유전자쌍이 더 많은 공간을 차지하려 해 결합각을 작게 만든다.
ex. CH4 109.5도 > NH3 107도 > H2O 104.5도
sp> sp2 > sp3 순으로 s오비탈스러운 성질을 가진다
가령 핵과 가깝다
p오비탈의 비중이 작으니 당연하다
2. 분자 오비탈 이론
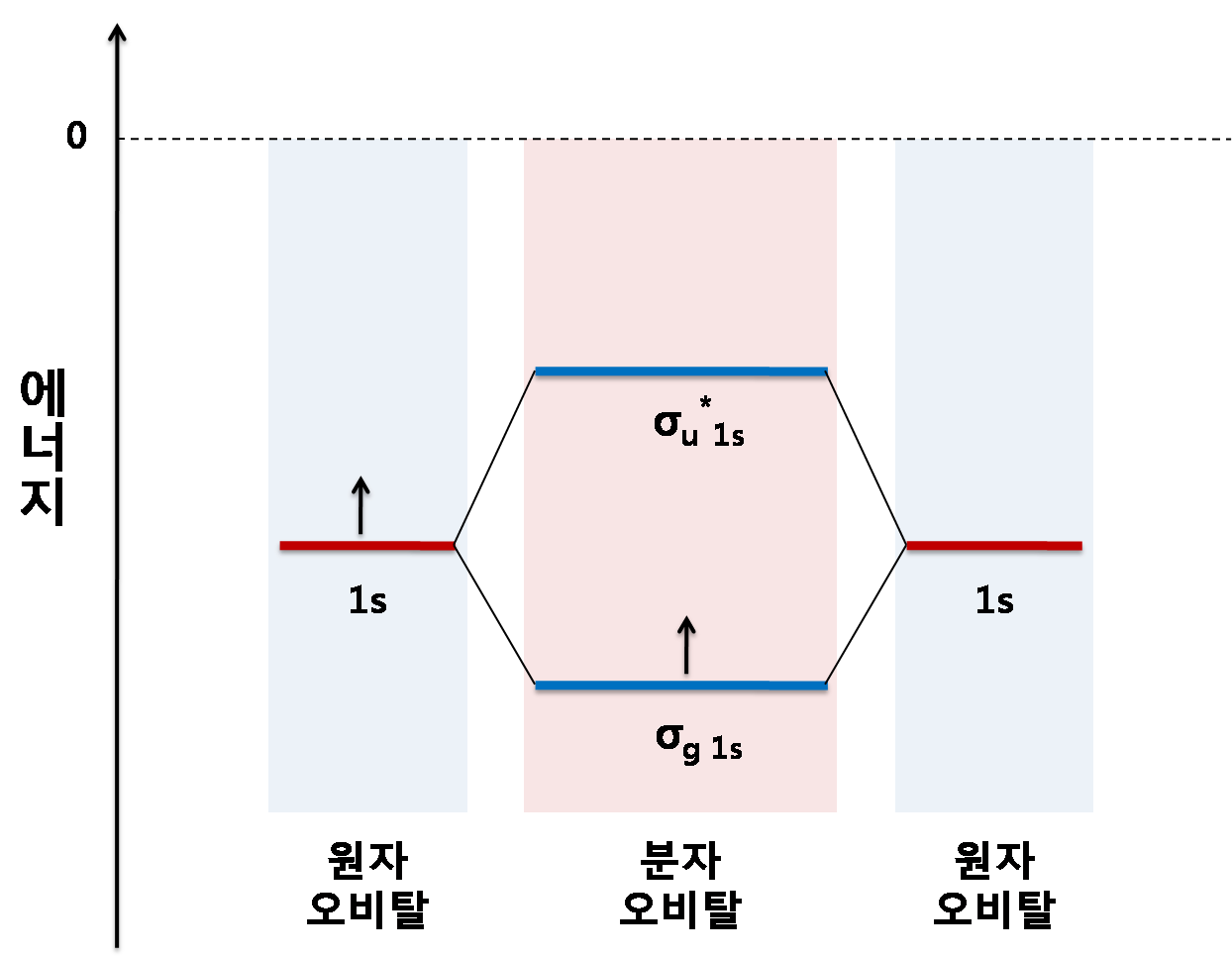

원자의 오비탈이 상호작용해 분자를 이루는게 아니라, (원자 사이에 편재된 전자)
분자 자체가 새로운 오비탈을 가진다는 접근이다. (분자에 걸쳐 비편재된 전자)
결합성 오비탈은 더 낮은 에너지를
반결합성 오비탈 더 높은 에너지를 가진다
전기음성도와 쌍극자모멘트
전기음성도(Electronegativity)
전기음성도: 공유전자쌍을 끌어당기는 정도를 말한다
분자를 이루는 원자 '간' 결합에서, 공유전자에 작용하는 힘
주로 다음과 같이 취급하지만 별 의미는 없다
0.5미만: 비극성 공유결합 ex.C-H
0.5~1.7: 극성 공유결합 ex.F-H
1.7 이상: 이온결합 ex.Na-Cl
쌍극자 모멘트
전기음성도 차이에 의해, 전자는 한쪽에 치우칠 수 있다.
그러한 분자를 극성 분자라고 한다
ex. COCl2
ex. NH3, H2O **비극성으로 헷갈리지 않게 주의해야 한다! 비공유 전자쌍에 의해 쌍극자모멘트가 상쇄되지 않는 구조가 된다
한 편 모든 쌍극자모멘트 벡터가 서로 상쇄되면
비극성 분자가 될 수 있다
ex. CO2, CCl4
애초에 쌍극자모멘트가 없는 경우엔 당연히 비극성 분자다
ex. H2
분자 간 힘
| 쌍극자-쌍극자 힘 | 수소 결합 | 런던 분산력 |
| 극성 분자 |
특히 전기음성도 차이가 큰 N-H O-H F-H 결합을 가지는 분자 ex. H2O, NH3... |
모든 분자가 가짐 |
| 극성 분자에서 부분 양전하, 음전하 간 인력 |
부분양전하 H와 부분음전하 NOF 간 인력 | 순간적으로 전자가 쏠려 순간적인 부분 양전하, 음전하가 생기면 분자 간 인력이 생김 |
*참고로 소수성효과는 힘이 아니고, 엔트로피에 의해 뭉치게 될 뿐임
이러한 분자 간 상호작용 힘 때문에,
극성은 극성을, 비극성은 비극성을 좋아하는 용매효과가 있음
'유기화학' 카테고리의 다른 글
| [유기 화학] 2. 산과 염기 (Acids and Bases) (0) | 2024.07.11 |
|---|---|
| [유기 화학] 1-3. 공명(resonance) (0) | 2024.06.29 |
| [유기 화학] 1-2. 작용기(Functional Group) (0) | 2024.06.28 |
| [유기화학] 1-1. 골격구조식(bond-line structure), wedge&dash (0) | 2024.06.28 |
| [유기 화학] 0-2. 화학반응의 이해 - 열역학, 반응속도론 (0) | 2024.06.28 |




댓글