공유 결합 화합물 - 구조 모형
<흐름 읽기>
VBT 모델 (원자가 결합 이론) : 루이스 구조+VSEPR+혼성화 이론(양자 역학)
편재된 전자 모형 (LE model)
1. 루이스 구조 - 원자가 전자 배치 설명
전자가 핵과 핵 사이에 편재되어 있다고 친 후, 원자가 전자의 홀전자의 전자쌍 결합으로 설명
불활성 기체와 같은 전자 배치 - duet rule, octet rule
2. 원자가 껍질 전자쌍 반발 (VSEPR) 모형 - 분자 구조 예측 → 루이스 구조만 알고도 구조 예측 가능
BUT.. 이로는 설명할 수 없는 것들이 있다
-홀전자만 결합에 참여한다면 CH4는 뭔데?
-또 CH4의 전자쌍들의 각도는 90도가 아니라 109.5도이다
▶▶▶ 혼성 오비탈 등장
3. 혼성 오비탈 - 본래의 원자 오비탈이 아닌 다른 형태의 원자 오비탈을 사용한다
BUT.. 이로는 설명할 수 없는 것들이 있다
-전자는 사실 비편재 되어 있다
-홀 전자, 공명을 잘 설명하지 못한다
▶▶▶ 분자 오비탈 모델이 등장 - 원자 오비탈을 구하듯, 양자 역학적으로 분자 오비탈을 구한다
사실 이게 맞는 거임
MOT 모델
4. 분자 오비탈 모델 - 원자 오비탈을 구하듯, 양자 역학적으로 분자 오비탈을 구한다
사실 이게 맞는 거임
***이제 와서 보니 이게 아닌 듯
분자를 접근하는 두 가지 방식
기본적으로는 **오비탈의 중첩으로 분자가 생성된다고 보지만
1. VBT는 원자오비탈의 단순 보강/상쇄 간섭으로 접근하고
2. MO는 수학적 모델로 분자오비탈을 계산. 즉 원자처럼 하나로 봄 (보강/상쇄 간섭도 o)
**이 중첩되는 오비탈을 원자오비탈 그대로가 아니라, 혼성화된 오비탈로 한다는게 혼성 오비탈
VSEPR은 혼성오비탈+SN개수로 구조 예측 모델 (VBT에 가까운 듯??)
VBT 모델 (원자가 결합 이론) : 루이스 구조+VSEPR+혼성화 이론(양자 역학)
루이스 구조
원자가 전자 배치 설명
-전자가 핵과 핵 사이에 편재되어 있다고 친 후, 원자가 전자의 홀전자의 전자쌍 결합으로 설명
-불활성 기체와 같은 전자 배치 - duet rule, octet rule
원자가 전자수의 합을 세고, 일단 단일 결합을 그려주고, 남은 전자쌍을 잘 배치하며 그 총수가 유지되도록 한다
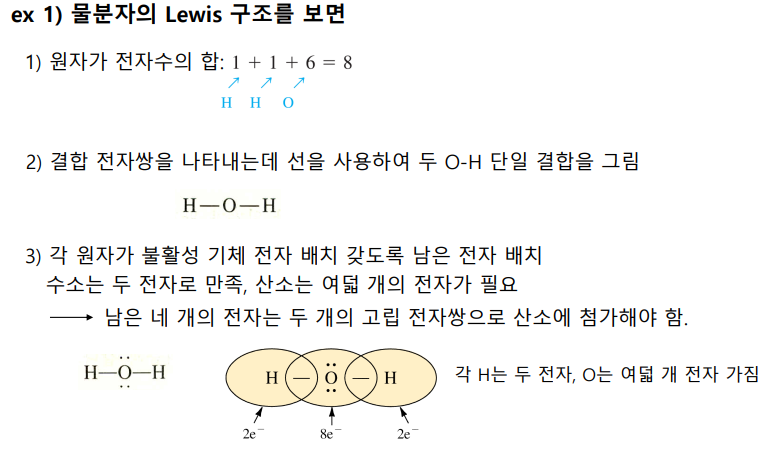



팔전자 규칙 예외
붕소, PCl5, I3- ...



공명
둘 이상의 Lewis 구조가 가능한 경우
실제 구조는 여러 공명 구조의 평균이다 ex. NO3-는 1.5중 결합과 같은 결합 길이와 세기
실제로 전자는 편재되어 있다. 즉 분자 전체에 걸쳐 움직인다!

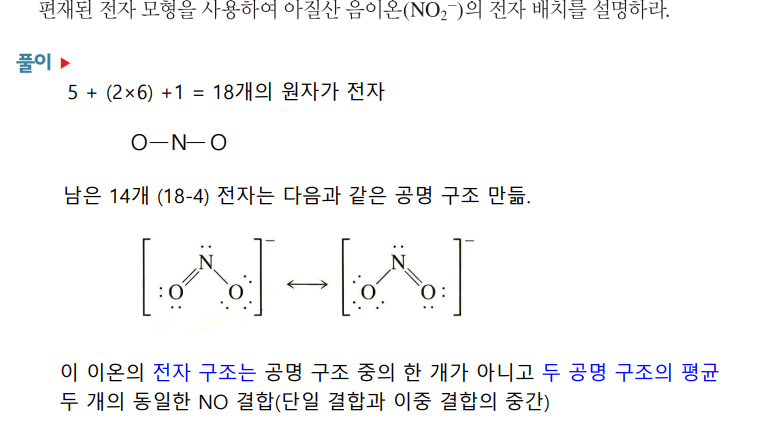
형식 전하
형식전하 = 중성원자 원자가 전자 수-분자 내 원자에 속하는 원자가 전자 수(***공유 전자는 동등하게 할당된다고 가정
팔전자 규칙을 초과하는 경우, 여러 동등하지 않은(공명과의 차이점) 루이스 구조가 가능하다
이 중 무엇이 적절할지, 형식 전하 개념을 이용해 추정할 수 있다
→ (1)형식 전하가 0에 가깝고, (2)전기음성도가 큰 것이 음의 형식전하여야 타당한 구조이다
VSEPR 모형
루이스 구조를 그린 후, 분자 구조를 예측할 수 있는 모형
전자쌍의 반발을 최소화 하는 방식
전자쌍 개수를 센다 → 선형/삼각평면/사면체/삼각쌍뿔/팔면체 류 → 구조 이름은 원자 기준으로만


* 결합 전자쌍 vs 고립 전자쌍
결합 전자쌍은 두 원자핵 사이 공유
고립 전자쌍은 한 원자핵에만 근접
→ 더 많은 공간 차지, 결합 각에 영향
→ 고립 전자쌍이 최대한 멀도록
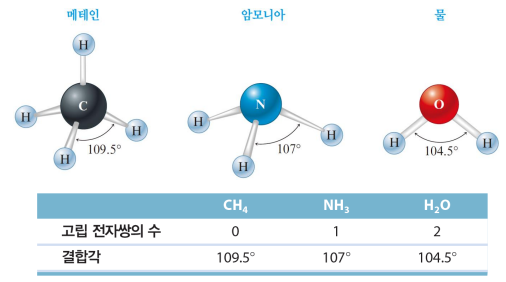

*다중 결합도 하나로 침

혼성 오비탈 이론
여러 가지 문제들을 해결해야 함
- 홀전자만 결합에 참여한다면 CH4는 뭔데?
- 또, 오비탈을 그대로 이용하면, CH4의 전자쌍들의 각도는 90도가 아니라 109.5도이다
▶▶▶ 혼성 오비탈 이론이 등장 - 본래의 원자 오비탈이 아닌 다른 형태의 원자 오비탈을 사용한다
주의: 여전히 원자 사이에 편재되어 있다고 봄! 다른 형태의 원자 오비탈을 쓸 뿐이다
문제에서 만난다면?
루이스 전자식 구하고 → 중심 원자 전자쌍 개수를 세어서(SN) → 혼성 오비탈 유형을 찾는다
SN과 혼성화 유형
기존 원자 오비탈 간 일어나는 혼합
< SN(Steric Number): 중심 원자의 공유 전자쌍 수 + 비공유 전자쌍 수 >를 통해 혼성 유형을 알 수 있음
***SN에서 공유 전자쌍은 시그마 결합만 센다 → 즉, 다중 결합이면 하나만 센다
즉, 기본 틀 구조 모형으로 파악한다고 생각하면 됨


혼성화 유형
| sp SN=2일 때 (180도st) s 1개 + p 1개 / p 2개는 그대로 |
sp2 SN=3일 때 (120도st) s 1개 + p 2개 / p 1개는 그대로 |
sp3 SN=4일 때 (109.5도st) s 1개 + p 3개 |
  |
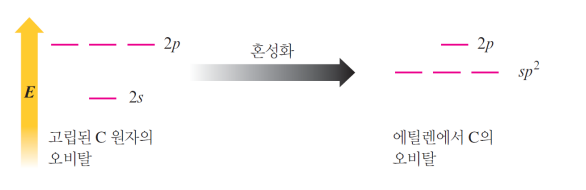  |
  |
p 오비탈이 2개 남은 모습 |
p 오비탈이 1개 남은 모습 |
*팔전자계 규칙 벗어나는 경우의 혼성 오비탈
| dsp3 SN=5 (삼각쌍뿔st) ex. PCl5 d 1개 + s 1개 + p 3개 |
d2sp3 SN=6 (8면체st) ex. SF6 d 2개 + s 1개 + p 3개 |
 |
 |
시그마 결합, 파이 결합
시그마 결합이 1개,
다중 결합이면 파이 결합이 하나씩 더해짐
| 시그마 결합 | 파이 결합 |
| 두 오비탈의 로브가 서로 맞닿아 직접 겹쳐짐 | 평행한 두 p 오비탈이 옆으로 겹쳐져 만들어짐 |



MOT 모델
편재 전자 모형의 문제점
-전자는 사실 비편재 되어 있다
-홀 전자, 공명을 잘 설명하지 못한다
▶▶▶ 분자 오비탈 모델이 등장 - 원자 오비탈을 구하듯, 양자 역학적으로 분자 오비탈을 구한다
사실 이게 맞는 거임
단점은 가시화하기 어렵다는 것?
MOT 모델
분자를 새로운 실체로 보고, 원자 오비탈을 구하듯, 양자 역학적으로 분자 오비탈을 구한다
즉, 분자 오비탈의 제곱으로 분자 내 전자 발견 확률을 구한다
*** 원자 오비탈의 총수 = 분자 오비탈의 총수
*** 원자의 원자가 오비탈만 MO에 기여
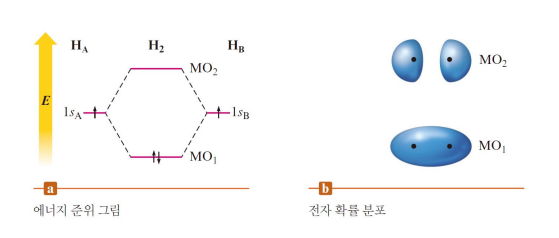
수소분자의 분자 오비탈
파동함수의 제곱을 통해 전자의 존재 확률 구할 수 있음
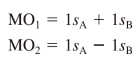
위상으로 인한 보강, 상쇄
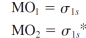
낮은 에너지인 bonding MO에 들어가려 함
MO를 보면 존재 확률이 가장 큰 곳은 두 핵 사이, 낮은 에너지의 bonding MO
antibonding MO*는 반면 핵의 반대편에 위치함
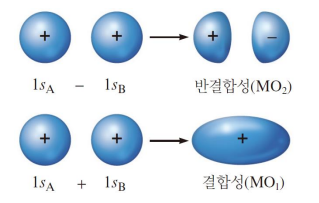
결합성 오비탈, 반결합성 오비탈
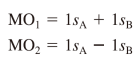


| 결합성 오비탈 | 반결합성 오비탈* |
| 위상이 같은 부호라 보강간섭 원자 오비탈보다 낮은 에너지 상태 → 분자 생성의 원인    |
위상이 다른 부호라 상쇄 간섭 원자 오비탈보다 높은 에너지 상태    |
결합 차수

결합의 세기를 나타내는 개념. 결합 차수가 클수록 결합이 세다
이걸로 분자의 형성 여부를 예측할 수 있음
(결합성 전자 총 수 - 반결합성 전자 총 수)/2
(1) H2- 이온
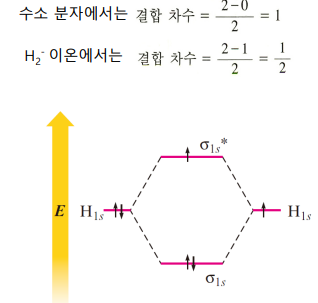
He2 분자가 존재할 수 없는 이유
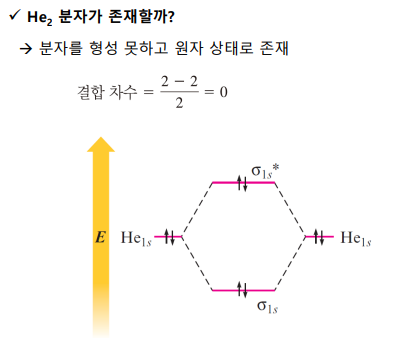
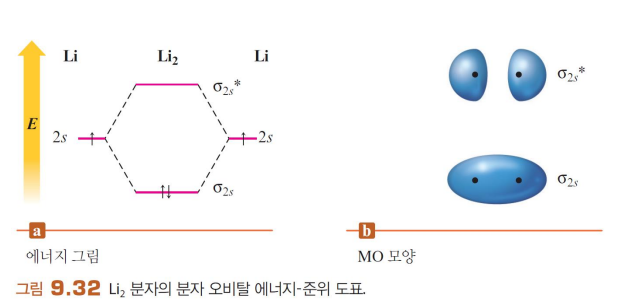
Li2 분자는 존재할 수 있다
*** 1s 오비탈 간은 중첩이 일어나지 않음. 너무 작기 때문이다. 원자의 원자가 오비탈만 MO에 기여
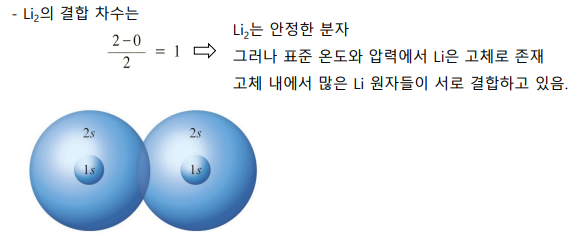
시그마 오비탈, 파이 오비탈
| <시그마 분자 오비탈> -정면으로 겹침(s끼리, p 1쌍) ***핵 사이, 핵 바깥에 오비탈 위치 |
<파이 분자 오비탈> -평행한 형태로 겹침(p의 나머지 2쌍) ***원자핵 결합선 아래 및 위에 위치 → 마디평면 존 |
  |
 |

동핵 이원자 분자의 결합 - 분자의 광전자 분광법

주기에서 오른쪽 2개와 나머지의 오비탈 양상이 다름
s랑 p의 혼합이 갈수록 흐려져서라는데.. 몰랑ㅎ
PES 스펙트럼의 주요 에너지 흡수띠 - 분자 오비탈 도표와 잘 맞음

이핵 이원자 분자의 분자 오비탈
이웃한 원자는 서로 비슷해서 동핵 이원자 분자와 같이 그리면 되지만,
두 원자가 매우 다르면 매번 새롭게 그려야 한다



[편재 전자 모형+분자 오비탈 모형]의 결합 - 공명 구조의 설명
둘을 결합해 공명을 잘 설명함
전자가 편재되어 있다고 가정하면 공명이 1.5중 결합 같은 성질을 가지는 것을 설명하지 못함
편재 모형에서의 시그마 결합/파이 결합 도입
시그마 결합은 편재 모형으로 그대로 설명
파이 결합은 MOT로 설명 (비편재화된 파이 결합)



'일반화학 > 일반화학 개념정리' 카테고리의 다른 글
| <일반 화학> 11장- 용액의 특성 (0) | 2023.05.30 |
|---|---|
| <일반 화학> 10장- 액체와 고체 (1) | 2023.05.24 |
| <일반 화학> 8장- 결합: 일반 개념 -1 (1) | 2023.05.18 |
| <일반 화학> 7장- 원자 구조와 주기성 (0) | 2023.05.14 |
| <일반 화학> 6장- 열역학 (0) | 2023.05.09 |






댓글