줌달의 일반화학 10판 정리 필기
문제 풀며 느낀 것들
반응식의 엔탈피는 열만 고려하지 일과는 무관하다
일은 반응물, 생성물의 기체 몰수를 비교해서, 부피가 어떻게 변하는지에 달림
비열 구할 때 물질까지 넣은 용액의 무게로 계산
1L*atm=101.325J
이것은 R=0.08206어쩌구=8.3145어쩌구 였던 것을 이용해도 알 수 있음
의외로 이전 내용이 많이 쓰인다..
-명명법 금속 분류 등..
에너지의 기본
에너지: 일을 하거나 열을 발생 시킬 수 있는 능력
ΔE=q+w
E=PE+KE
에너지, 일, 열의 단위

1atm*L=101.325J
에너지 보존의 법칙 (열역학 제 1법칙)
에너지는 다른 형태로 바뀔 뿐, 소멸하거나 생성되지 않음. 우주의 에너지는 일정
에너지의 분류
에너지 = 퍼텐셜 에너지 PE + 운동 에너지 KE
| 퍼텐셜 에너지 PE | 운동 에너지 KE (mv^2/2) |
| 위치 or 조성의 변화에 따른 에너지 일(에너지)=Fs=mgh (g=9.81m/s^2) -화학 결합에 퍼텐셜 에너지가 저장됨 |
물체의 운동에 따른 에너지 -열 에너지도 무질서한 운동 에너지 |
에너지의 전달 방식
ΔE=q+w
| 열(heat) | 일(work) |
| 두 물체의 온도차에 의한 에너지 전달 ***온도 vs 열*** 온도: 입자의 무질서한 운동의 척도 >> 물체의 특성 열: 에너지의 이동 >> 물체의 구성요소가 아님 |
일정한 거리에 걸쳐 작용한 힘 |
상태 함수(상태 성질)
경로 무관, 처음 상태와 마지막 상태에 의해서만 결정
ΔE, E는 상태함수이나, q w는 상태함수가 아니다
화학 에너지
계와 주의
계(system): 우주에서 관심 대상인 부분 - 반응물과 생성물로 정의
주위(surrounding): 그 외 모든 부분
내부 에너지: 계의 모든 입자의 에너지
계와 부호
ΔE=q+w에서 >> 계의 에너지가 줄어들면 - , 늘어나면 +
q의 부호: E를 방출하면 -, 흡수하면 +
w의 부호: 일을 가하면(팽창하면) -, 일이 가해지면(압축되면) +
*기체에 의한 일 - 팽창 압축과 w
기체의 압력 P=F(힘)/A(면적)
F=PA
일=힘*거리=PA*Δh=PΔV
단, 팽창하면 일을 하는 것이니 -여야 함
w=-PΔV
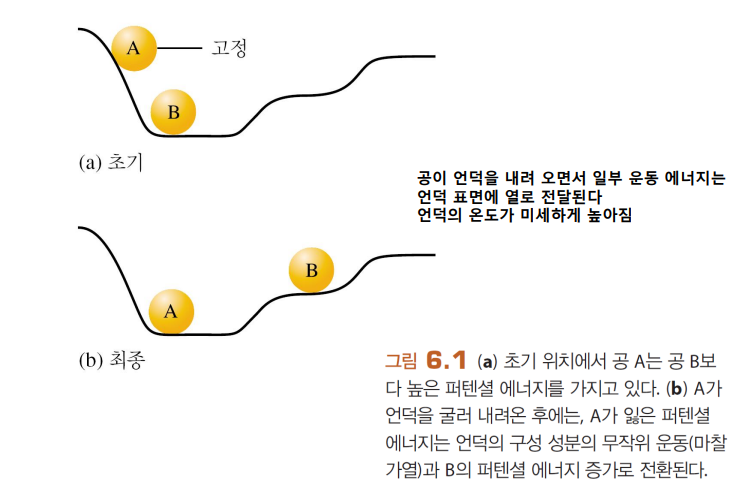
발열반응과 흡열반응
이러한 반응의 열로 전달되는 에너지는, 생성물과 반응물의 퍼텐셜 에너지 차이(생성물 PE-반응물PE)에서 나옴
반응물의 결합을 끊을 때 필요한 E, 생성물의 결합이 생성될 때 발생하는 에너지의 차이
| 발열반응 | 흡열반응 |
| 열이 발생, 즉 에너지가 계로부터 방출 -화학 결합에 저장되었던 퍼텐셜 에너지(ΔPE) 일부가 열을 통해 열에너지(무질서한 운동 에너지)로 변환 -생성물의 결합이 더 강하다 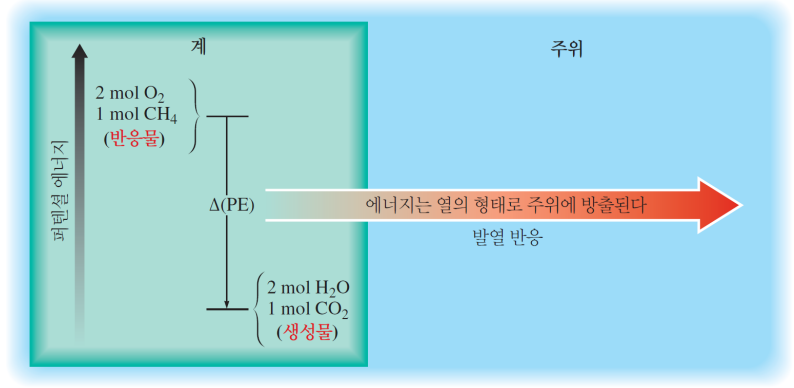 |
계가 주위로부터 열을 흡수 -생성물이 반응물보다 큰 퍼텐셜 에너지(약한 결합)를 가진다  |
| ΔH=q<0 즉, 생성물의 엔탈피가 더 작음 |
ΔH=q>0 즉, 생성물의 엔탈피가 더 |
*결합이 강하다? 결합이 잘 깨지지 않는다=안정하다=에너지가 낮다 > 에너지가 방출
엔탈피
H=E+PV **일정한 압력, 압력-부피 일만이 일을 결정
ΔH=q
ΔH=H생성물-H반응
즉, 엔탈피의 변화는 일정 압력에서 열로서의 에너지 흐름(계가 얻거나 잃은 열=반응)
엔탈피는 왜 있는 걸까.. 정말 혼란스러워..그치만 뇌 빼고 단순히 생각하면.. ΔH는 반응 중 출입열이다(일정 압력 조건)...
(일이 없는 것은 아님. 부피 변화에 의한 일은 존재할 수 있음)
유도
일정한 압력에서
ΔE=q+w=q-PΔV=q-ΔPV
q=ΔE+ΔPV
ΔH=q라고 하면
ΔH=ΔE+ΔPV
H=E+PV
엔탈피는 상태함수이다 (E+PV이기 때문)
엔탈피는 무엇을 의미하지? 그리고 왜 있는가?
특정 물질이 특정 온도, 압력(그래서 표준상태를 상정하곤 함)에서 가지는 고유한 에너지 함량
엔탈피의 변화는 등압조건에서 반응 중 출입열
일단 일정한 압력은 일반적 조건이다. 대기압은 일정하기 때문.
열에너지 총량인 H자체는 구하기 힘들며, 화학반응에서 열에너지 변화인 ΔH가 유의미하다.
등압 조건에서 출입하는 열은 엔탈피 변화, 즉 ΔH로 구할 수 있게 된다
ΔH는 열의 형태로 전달되는 에너지의 변화량!!
ΔH(엔탈피 변화)와 흡열, 발열 반응
흡열: ΔH>0
발열: ΔH<0
*ΔH=H생성물-H반응물
열량계
열량계: 화학 반응 과정 중 열의 흐름을 실험적으로 측정하는 장치
열용량(C) = 흡수된 열/온도 증가 ***물질마다 고유한 다른 값 가
-몰 열용량: 1mol 1°C 올리는 데 필요한 E J/°C*mol
-비열: 1g 1°C도 올리는 데 필요한 E J/°C*gl
열량계로 열 구하기
s*m*ΔT (용액 비열*용액 질량*온도 상승분)
일정 부피 통 열량계
일을 하지 않으니
ΔE=q+w=q+0=q=ΔH
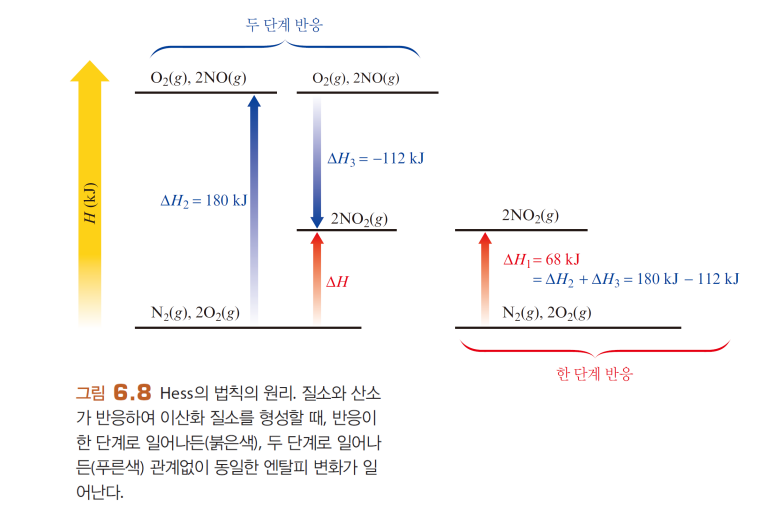
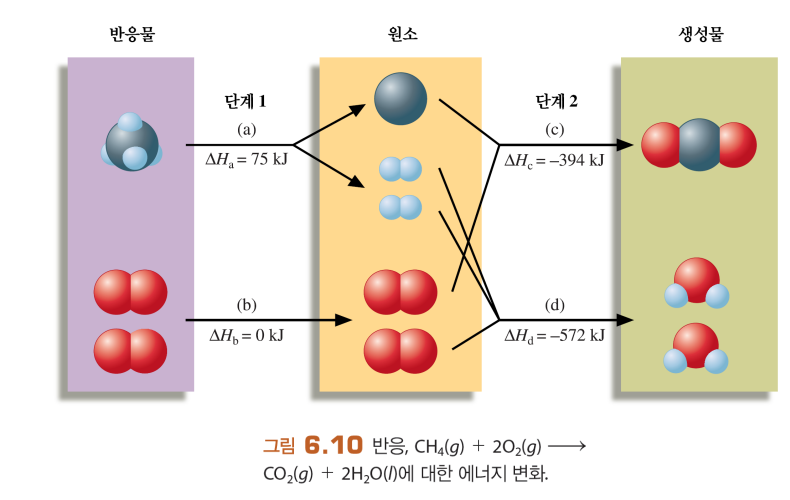
헤스 법칙
엔탈피, 엔탈피 변화량이 경로무관한 상태함수임을 이용
-역반응 부호, 물질의 양 배수곱에 주의
표준 생성 엔탈피(ΔHf°)
표준상태에서, 원소로부터 화합물 1mol이 형성될 때 수반되는 엔탈피 변화
***표준상태***
1atm, 25°C
원소가 해당 조건에서 존재하는 형태
화합물은 액체나 고체는 순수한 상태, 용액은 1M

STP(0°C 1atm)과 혼동하지 마!!
화학반응에서 헤스법칙-표준 생성 엔탈피 응용

ΔH=(생성물의 생성 엔탈피)-(반응물의 생성 엔탈피)
반응물의 표준 생성 엔탈피 역반응, 생성물의 표준 생성 엔탈피를 이용
'일반화학 > 일반화학 개념정리' 카테고리의 다른 글
| <일반 화학> 8장- 결합: 일반 개념 -1 (1) | 2023.05.18 |
|---|---|
| <일반 화학> 7장- 원자 구조와 주기성 (0) | 2023.05.14 |
| <일반 화학> 5장- 기체 (0) | 2023.05.08 |
| <일반 화학> 4장- 화학반응의 종류와 용액의 화학량 (0) | 2023.05.08 |
| <일반 화학> 3장- 화학량론 (1) | 2023.05.08 |








댓글