압력
압력은 기체의 특성!
Torricelli 기압계, 대기압
760mmHg의 압력 = 대기압(중력에 의해 당겨진 공기의 압력 > 높은 고도에서는 압력이 낮다)
압력의 단위
1atm = 760mmHg = 760torr = 101,325Pa(N/m^2)
*SI계 단위는 Pa
보일, 샤를, 아보가드로의 기체 법칙
| Boyle의 법칙 | Charles의 법칙 | Avogadro의 법칙 |
| PV=k (일정 T에서) 즉, 일정한 온도와 몰에서 기체의 압력과 부피는 반비례한다  |
V=bT(일정 P에서) ***단 이때의 T는 Kelvin온도이다 즉, 일정한 압력에서 부피는 온도에 선형적으로 증가  |
V=an (일정 P,T에서) 즉, 일정한 온도와 압력에서 부피는 기체의 몰수에 정비례 |
*대체로 낮은 압력, 높은 온도에서 잘 맞음
이상기체 법칙
세 가지 법칙을 V를 좌변으로 몰아 합쳐 PV=nRT
기체 상수 R
R=0.08206 L*atm/K*mol
R= 8.3145J/K*mol = 8.3145 (kg*m^2/s^2)/K*mol
표준 온도와 압력(STP)
0섭씨도, 1atm
이 때의 몰부피는 22.42L
몰질량으로 나타내기
PV=nRT의 n을 m/M(몰질량) 으로 대치 후, m/V=d(밀도)로 바꾸면
PM=dT
Dalton의 분압 법칙
기체 혼합물 전체 압력 = 각 기체 부분 압력의 합
n=n1+n2+n3+ ... 이기 때문

*기체의 종류는 중요하지 않음(2가지 가정에 근거)
가정 1. 각 기체 입자의 부피는 중요하지 않다
가정 2. 기체 입자 간 상호작용하는 힘은 중요하지 않다
*몰분율 (mole fraction) χ
n1/n전체 즉, 혼합물 전체 몰수 중 주어진 성분의 몰수의 비
n은 P에 비례하니 P1/P로도 나타낼 수 있음
따라서 P1=X1*P전체

*물의 증기압, 수상치환
증기압: 물 증발속도=응축속도 시 수증기의 압력
수상치환 시 기체의 압력은 물의 증기압을 뺀 만큼이다

기체의 분자 운동론
분자운동론(kinetic molecular theory, KMT)
이상 기체의 성질을 설명하기 위해 만들어진 이론
가정
1. 입자의 부피는 무시 가능
2. 입자가 운동하며 벽에 충돌하는 것이 압력의 원인
3. 입자 간 힘은 무시
4. 기체 입자 집합의 평균 운동 에너지는 Kelvin 온도에 정비례
> PV=k - 부피가 줄어들면 벽면 충돌이 늘어난다
> P=aT - 온도가 높아지면 운동 속도가 빨라져 충돌이 늘어난다
> V=bT - 온도가 높아지면 충돌이 늘어날테니 압력이 유지되려면 부피가 늘어나야 한다
> V=cn - 개수가 많아지면 충돌이 늘어나니 압력이 유지되려면 부피가 늘어나야 한다
> 달톤의 법칙 - 모든 기체 입자는 독립적이고 입자 자체의 부피는 무시된다고 가정한다
이상 기체 법칙의 유도
F=ma, P=힘/면적 .. 등을 이용해 유도하면..
언젠가는.. 제대로된 내 추가를..

(KE)평균 (기체 입자 집합의 평균 운동 에너지)
아래와 같기 때문에 절대온도에 비례한다



>>따라서 캘빈 온도는, 기체 입자의 무질서한 운동의 지표이다
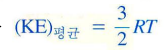
제곱평균근 속도

KE에서 유도하면 루트[3RT/M]
그 때의 R= 8.3145J/K*mol = 8.3145 (kg*m^2/s^2)/K*mol이다
J은 kg*(m/s)^2기 때문이다
*****이 때 M이 R 단위와 매치되려면 kg으로 다루어져야 한다
따라서 속도의 분포는 높은 온도에서 평균이 당연히 커지고, 분포도 다양해진다

따라서 속도는 분자량의 제곱근에 반비례한다

분출, 확산 속도도 그러하다
*Graham의 분출 법칙 : 동일 T, P에서 두 기체의 상대적 분출 속도는 기체 입자 질량의 제곱근에 반비례

-분출: 기체가 작은 구멍을 통해 빈방으로 가는 것-확산: 다른 종류의 기체가 충돌, 운동하며 섞임
실제 기체
Van der Waals 방정식 반데르발스

nb는 입자 자체의 부피를 고려해 V를 줄여줌
a(n/V)^2는 입자 간 상호작용인 인력으로 인한 P의 감소를 보정해줌
'일반화학 > 일반화학 개념정리' 카테고리의 다른 글
| <일반 화학> 7장- 원자 구조와 주기성 (0) | 2023.05.14 |
|---|---|
| <일반 화학> 6장- 열역학 (0) | 2023.05.09 |
| <일반 화학> 4장- 화학반응의 종류와 용액의 화학량 (0) | 2023.05.08 |
| <일반 화학> 3장- 화학량론 (1) | 2023.05.08 |
| <일반 화학> 2장- 원자, 분자와 이온 (0) | 2023.05.01 |




댓글