줌달의 일반화학 10판 정리
들어가며...



기체: 멀리 떨어진 입자, 빠르게 움직임, 입자 간 인력이 거의 없음 // 밀도 갑자기 낮아짐
액체: 가까운 입자, 움직임, 인력 셈
고체: 가까운 입자, 고정되어 안움직임(진동), 인력 셈
<액체 → 고체>보다 <액체 → 기체>에 필요한 에너지가 훨씬 크다
→ 액체, 고체는 분자 간 힘이 작용해 응집된 응축 상태로, 성질이 비슷하다
(1) 분자 간 힘 - 액체, 고체의 성질
(2) 액체의 3가지 성질
(3) 고체의 분류와 구조
(4) 상 변화 - 증기압, 상평형 그림
분자간 힘
-고체와 액체에서 중요한 분자 간 힘!
-공유결합, 이온결합, 분자 간 힘
이온결합물질은 이온결합...
ex. NaCl
HCl은 아님
분자간 힘의 종류
쌍극자-쌍극자 힘
|
*수소 결합
|
런던 분산력
|
| 쌍극자 간 정전기적 인력 양극과 음극의 상호작용을 극대화하는 방식으로 배향 공유/이온결합의 1%의 힘, 기체에서는 거의 무의미함  |
쌍극자-쌍극자 힘 중 특별히 따로 취급 N, O, F와 H 결합 있는 분자 간 힘 -전기음성도가 큰 N O F → 극성이 커짐 -크기 작은 H → 쌍극자 간 가깝게 접근  |
쌍극자 모멘트가 없는 비극성 분자, 불활성 기체에도 존재하는 분자 간 힘 순간적인 비대칭적 전자 분포 순간 쌍극자, 그로 인한 유발 쌍극자  |
| 끓는 점 양상 *일반적: 분자량 커짐 - 분산력 커짐 - 인력 세짐 - 분자 간 힘 끊으려면 많은 에너지 필요 - 끓는점 높아짐 *그러나 수소 결합으로 인해 N, O, F 있는 애들만 예외적으로 끓는 점이 높다 (CH4는 비극성 분자) 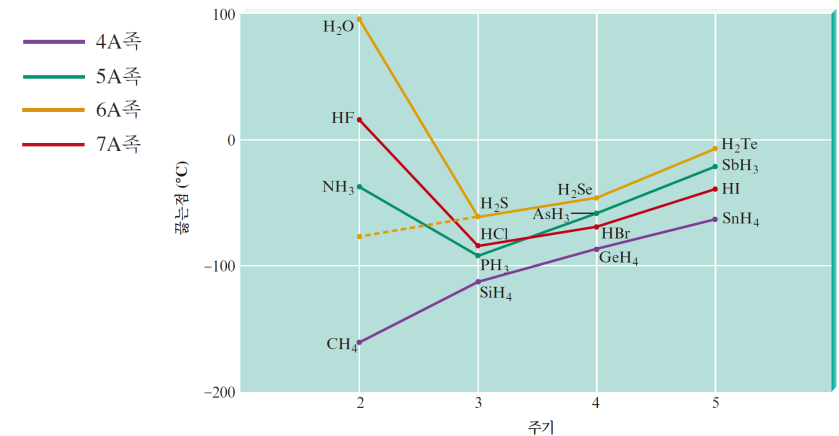 |
편극도(분극성) 분자량 큼(전자가 많음) - 더 많이 전자 분포가 비대칭적일 수 있음 - 편극도가 큼 - 런던 분산력이 큼 어는 점 양상 어는 점이 족에서 아래로 내려갈수록 분자량이 크고 전자도 많으니 어는 점도 상승 (즉 높은 온도에 불구하고 쉽게 인력이 형성 됨)  |
+) 극성 분자- 비극성 분자 간 힘
극성 분자의 영구 쌍극자가 비극성 분자의 쌍극자를 유도
비극성 분자의 전자가 많을수록 더 잘 유도 됨
분자의 화학적 변화 VS 물리적 변화
| 화학적 변화 | 물리적 변화 |
| 화학적 조성의 변화 분자 내 힘(화학결합)의 변화 ex. 물의 끓음, 상변화 |
물질 형태의 변화 - 분자는 그대로 분자 간 힘의 변화 ex. 물의 끓음, 상변화 |
*NaCl(s) → NaCl(aq)
이온성 고체의 용해기 때문에 물리적 변화이지만,
Na+와 Cl-로 깨지기 때문에 화학적 변화라 주장 가능
액체 상태의 성질
-대체로 분자 간 인력에 의해 나타나는 성질이다
액체의 3가지 성질
표면 장력 |
모세관 작용 |
점성도 |
| 액체가 표면적을 크게 하지 않으려는 현상 -표면적을 크게 하려면, 분자 간 힘을 극복하고, 액체 내부에서 표면으로 분자가 이동해야 하기 때문 액체 방울이 구형인 이유? -제일 겉의 분자는 밑, 옆으로만 인력을 받아 내부로 끌려가는 경향을 가짐 -따라서 최소한의 표면적을 가짐  |
액체 분자간 응집력, 액체 분자와 용기 간 접착력에 의한 현상 두 균형이 모양을 결정 *오목면- 접착력이 더 큼 *볼록면-응집력이 더 큼 ex. 극성 유리와 극성 물: 접착력 큼 ex. 극성 유리와 비극성 수은: 응집력 큼  |
액체가 흐르지 않으려는 정도 -분자간 힘이 크면 높은 점성을 가짐 ex. 강력한 수소 결합을 가진 글리세롤은 높은 점성을 가진다 -긴 분자는 얽히기 쉬워 큰 점성을 가짐 ex. grease는 가솔린보다 큰 점성   |
액체 구조 모형 연구
기체는 분자 간 힘 무시, 고체는 분자의 운동이 최소화
액체는 둘 다 있음 → 분광학(물질의 전자기 복사선 상호작용 이용) 이용
고체의 형태와 구조
-대체로 분자 간 인력에 의해 나타나는 성질이다
결정성 고체
비결정성 고체: 구조가 무질서함 -ex.유리: 질서정연해지기 전 얼어붙어 버린
결정성 고체: 구성 성분이 매우 규칙적인 배열을 함
▶이 중 결정성 고체에 대해 중점적으로 다룰 것이다!
단위세포와 격자
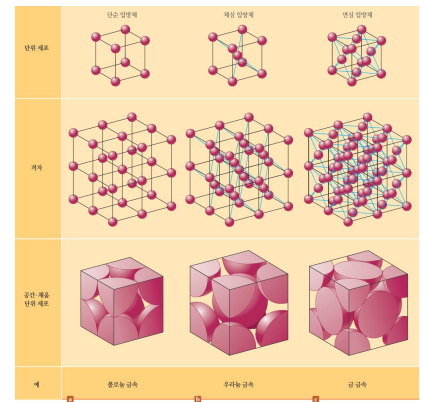
*단위세포
결정성 고체에서 격자의 반복되는 가장 작은 단위
구성성분(원자, 이온, 분자)의 위치를 지정
*격자
단위세포가 반복된 삼차원계
결정성 고체의 유형
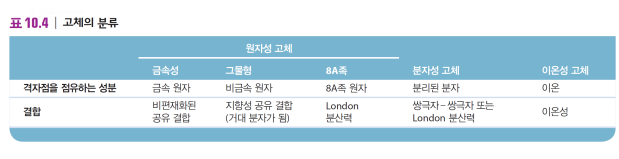
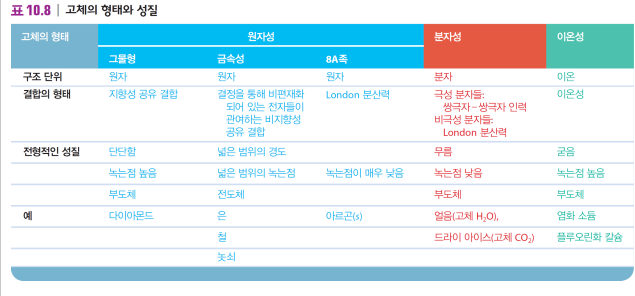
| 이온성 고체 | 분자성 고체 | 원자성 고체*** |
| 격자점을 이온이 차지 ex. 소금  |
격자점을 중성 분자가 차지 ex. 얼음, 설탕  |
격자점을 원자가 차지 ex. 탄소(흑연, 다이아몬드, 풀러렌), 붕소 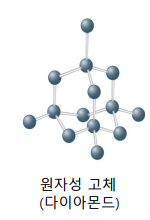 |
| ***또 한 번 나뉨 -금속성 고체 -그물형 고체 -8A족 고체 |
***원자성 고체의 유형
| 금속성 고체 | 그물형 고체 | 8A족 고체 |
| 금속 비편재화되고 지향성 없는 공유 결합 ex. 구리 |
거대 분자, 비금속 원자 강한 지향성의 공유결합 ex. 다이아몬드 |
비활성 기체 원자 런던 분산력 ex. 아르곤 |
※그물형 고체에 거대분자가 포함되는데,
얘는 구조가 그물형이긴 하나 원자성 고체가 아니라 분자성 고체다
3-1. 금속성 고체 - 구조와 결합
지향성 없는 공유 결합 - 열 전도도, 전기 전도도, 전성, 연성
-결합은 강한데(내구성 높고 녹는점 높음)
-지향성은 없음(변형이 쉬움-전성, 연성)
-열, 전기 전도성 좋음
최조밀 쌓임
모든 방향으로 서로 똑같은 결합을 한 채 밀집된 구형의 원자들
빈공간이 최대한 없도록 쌓은 방
두 가지 배열이 가능 △⊙△ △⊙▽
| aba 배열 -육방 단위 세포 -육방 최조밀 쌓임 구조 hcp -ababababa |
abc 배열 -면심 입방 단위 세포 -입방 최조밀 쌓임 구조 ccp -abcabc |
  |
  |
 |
Q>> 결국 둘이 성질은 똑같은건가???????
*두 구조의 공통점: 12개의 동일한 이웃을 가짐(3+6+3)
*면심입방구조(ccp)의 단위세포 속 구의 알짜 개수: 1/8 8개, 1/2 6개 → 4개
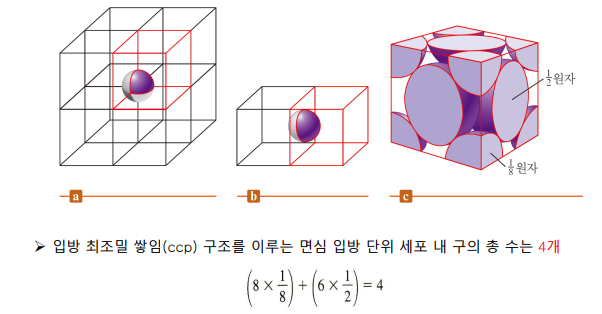
*면심입방구조(ccp)의 밀도

결합 모형
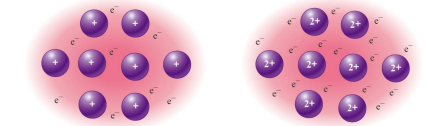
*전자 바다 모형
금속 양이온이 규칙적 배열, 움직일 수 있는 원자가 전자의 바다
-전자로 인해 전기 전도성
-양이온으로 인해 전성(얇게 펴는), 연성(길게 늘리는)
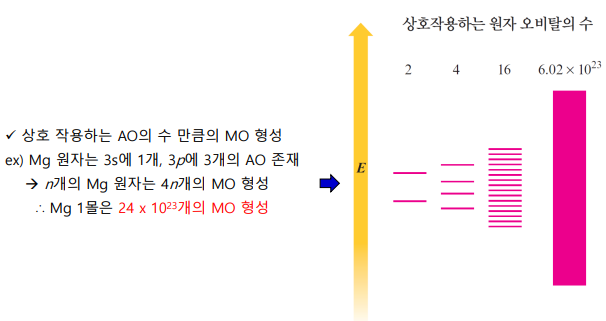
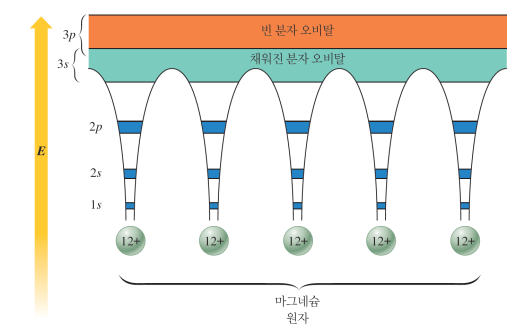
*띠 모형 = 분자 오비탈 모형
전자들이, 금속 원자들로 만들어진 분자오비탈들 속에서 이동한다 가정
수많은 금속 원자의 원자가전자 오비탈 간 상호작용 → 연속된 띠의 준위 → 원자가 전자들이 구성
빈 분자 오비탈(전도 띠)과 채워진 분자오비탈(원자가 띠)이 가까워 전자가 쉽게 이동 → 열, 전기 전도 좋음
(핵심부 오비탈은 편재됨)
합금
금속성 결정에 다른 원소를 넣음
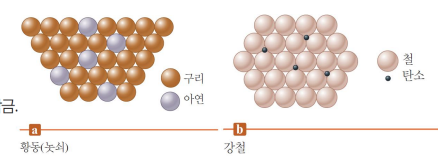
-치환형 합금: 주 금속 대신 비슷한 크기의 다른 금속 원자로 치환
-틈새형 합금: 최조밀 쌓임에서 틈새 자리에 작은 원자가 들어감
지향성을 가지며 더 단단해지기도.. 그 비율에 따라 성질도 달라지기도..
ex. 연철, 중강, 고탄소강, 합금강...
3-2. 그물형 원자성 고체
강한 지향성의 공휴결합을 가진 거대 분자
격자점을 원자가 차지
-잘 부서지고 열, 전기가 통하지 않음
탄소
| 다이아몬드 | 흑연 |
| sp3-sp3 공유결합 -채워진 준위, 빈 준위 간 넓은 간격 → 전기 절연체  |
sp2-sp2 공유결합 남은 2p 간 파이 결합 -흑연층의 안정도에 기여, 비편재화된 전자들로 전기전도성  |
흑연이 재배열되어 다이아몬드가 되려면, 흑연의 강한 결합이 파괴되어야 함
고온 고압.. 필요
규소
탄소와 같은 4A이지만 차이점들이 있음
- C는 C끼리만 공유결합하지만, Si 규소-산소 결합
- 3p는 커서 산소와 파이결합 불가능 → 단일결합 → 사실 상 SiO4 정사면체
| 실리카(SiO2, 즉 Si:O=1:2) |
규산염 음이온(O/Si가 2 이상, 초과 음이온으로 인해 금속 양이온 섞임) |
유리 (실리카 냉각한 비결정형 고체) 첨가물들 섞임 |
 |
 |
  |
*반도체
규소는 구조는 비슷하지만, 에너지 간격이 다이아몬드보다는 작음
→ 25도에서 이 간격을 뛰어 넘어 들뜰 수 있다 <반전도성 원소> <반도체>
→ 여분의 전자나 양공을 만들면 전도도가 더 좋아짐
| n-형 반도체 | p-형 반도체 |
| 여분의 전자 에너지가 전도띠에 가까워 전류가 흐름 ex. 원자가 전자가 하나 더 많은 비소 As  |
전자의 빈 양공이 이동, 원자가띠에 구멍 ex. 원자가 전자가 하나 더 적은 붕소 B  |
p-n 접합: p(+) n(-) 전지 연결해서 교류를 한 방향으로..
+분자성 고체
원자성 고체는 아니나 그물형임
각 격자점에 분리된 단위의 분자
ex. 드라이아이스, 얼음, S8, P4
분자 내 결합은 강하나, 분자 간 힘은 약함
-쌍극자면 쌍극자-쌍극자 힘(수소 결합 포함)
-무극성이면 런던 분산력
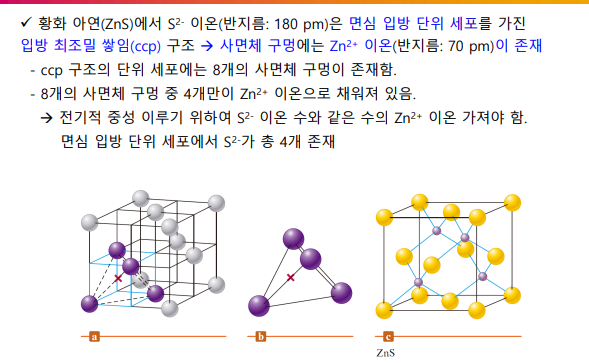
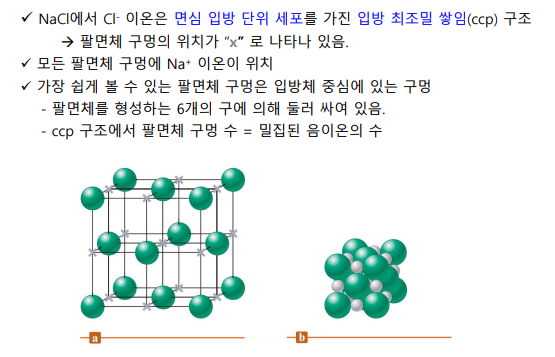
3-3. 이온성고체
이온 간 정전기적 힘
음이온의 최조밀 쌓임 구조 + 더 작은 양이온이 사이 구멍에 존재
전체적으로 중성이 되도록, 양이온:음이온 개수비가 형성되어야 함(구멍을 다 채우는게 아니라..)
*구멍: 삼각형<사면체(개수는 음이온 2배)<팔면체(개수는 음이온과 같음)
4면체와 8면체니까 2:1
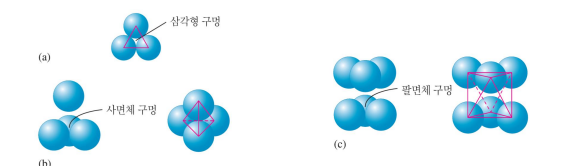
*양이온:음이온 개수 비율
상태의 변화
증기압
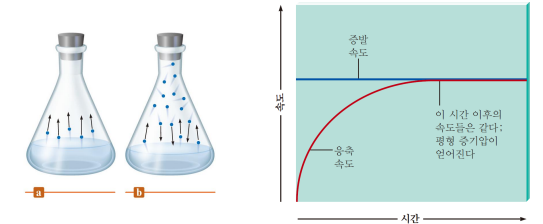
증발(기화): 액체의 분자 간 힘을 극복하고(흡열) 액체 분자가 액체 표면을 이탈해 기체가 됨
증발열(증발 엔탈피 ∆H증발): 1atm, 1mol 증발하는데 필요한 E
응축: 증기 분자가 액체가 되는 과정
승화: 고체가 기체가 됨
증기압(평형 증기압) 증발속도=응축속도일 때의 증기의 압력
분자 간 인력에 의한 고유의 값

온도, 분자 간 인력 - 증기압 관계
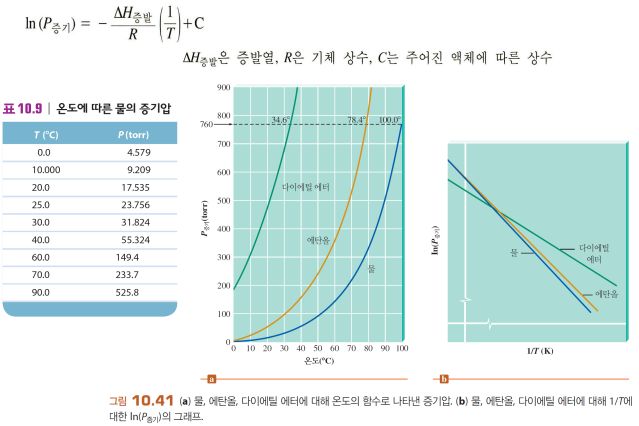
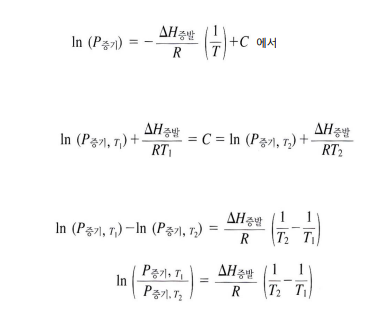

*분자간 인력이 강하면 증기압이 낮다 - 이탈하는데 많은 에너지가 필요하기 때문에 잘 이탈하지 않음
-비극성 분자: 분자량 크면 분산력 커서 증기압이 낮음
-물: 수소결합으로 인력이 세서 증발열이 큼, 증기압이 낮음
*온도가 높으면 증기압이 증가한다 - 이탈하기 위한 운동 에너지를 가진 분자수가 많아짐
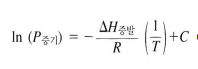
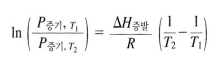
→ 온도, 증발 엔탈피, 증기압 가지고 특정 온도에서의 증기압 구할 수 있음
가열 곡선
일정한 에너지를 가하는 과정에 대한 시간-온도 그래프
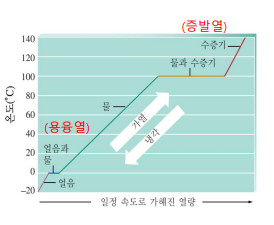
끓는점, 녹는점에서의 에너지는 전부 분자 간 결합을 끊는 데에만 이용됨 → 퍼텐셜 에너지 증가
-용융열(용융 엔탈피, ∆H용융): 고체가 녹을 때 발생하는 엔탈피 변화
-증발열(증발 엔탈피, ∆H증발): 1atm에서 1mol 증발하는 데 필요한 에너지
기울기는 비열이 작을수록 급격함
용융, 증발 중 길이는 필요한 엔탈피에 따라.. 비율 결정
*1mol 기준으로 몇 도 오르느냐.. 증발 용융 엔탈피 몇이냐.. 가지고 비교하며 그리는..
증기압 - 녹는점, 끓는 점 관계
물질의 녹는점, 끓는 점은 고체, 액체의 증기압이 결정한다
| 녹는점(고-액) <액체 증기압=고체 증기압>인 온도 |
끓는점(액-기) <액체의 증기압=주위 압력>인 온도 |
| 녹는점보다 낮은 온도: 고체 증기압<액체 증기압 평형을 위해 고체에서 증기 흡수 평형을 위해 액체에서 증기 방출 즉 액체 → 고체 고체만 남음 둘이 같을 때는 증기와 함께 고체-액체 공존 녹는점보다 높은 온도: 고체 증기압>액체 증기압 평형을 위해 고체에서 증기가 방출 평형을 위해 액체에서 증기를 흡수 즉 고체 → 액체 액체만 남음 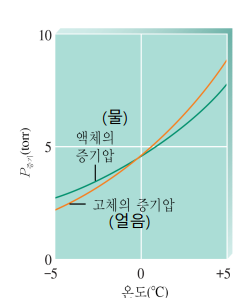  |
-액체 내에서 증기의 기포가 형성되어야 끓을 수 있음 끓는점보다 낮은 온도: 액체의 증기압<주위 압력 액체 표면의 압력이 더 큼 기포 생성 불가능 or.. 액체로 증기가 흡수되나? 끓는점: 액체의 증기압=주위 압력 기포가 형성될 수 있기 시작 끓는점보다 높은 온도: 액체의 증기압>주위 압력 기체가 되려 증기를 방출함? 그러다 기체만 남는  |
결국 증기압이 높은 애를 따라가나?? 그리고 걔가 평형될 때까지 남는??
***증기압은 결국 평형을 위한 거니까.. 고체나 액체 자체의 압력이기도 한건가?
-정상 녹는점: 1atm에서의 녹는점
-정상 끓는점: 1atm에서의 끓는 점
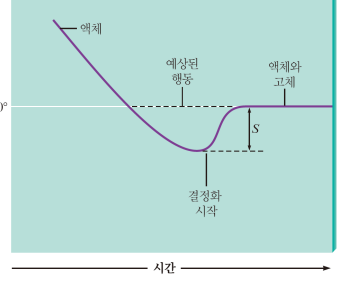
과냉각, 과열
상태변화가 항상 정확한 끓는점, 녹는점에서 일어나지는 않는다
과냉각: 녹는점 아래에서도 액체 상태
녹는점에서도 고체가 되도록 배열되지 않았을 때
과열: 끓는점 이상으로까지 액체의 온도를 올릴 수 있음
급하게 가열해서 기포가 충분히 형성되지 않음
액체의 증기압이 대기압보다 크기 때문에, 대기압보다 액체 압력이 커서 bumping이 일어남
상평형 그림
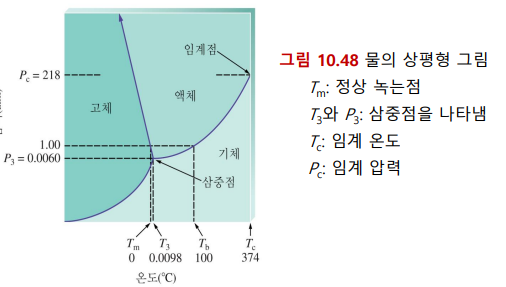
물질의 상태를 온도와 압력의 함수를 나타냄 (주어진 T, P에서 어떠한 상일 것인가?)
닫힌계 조건
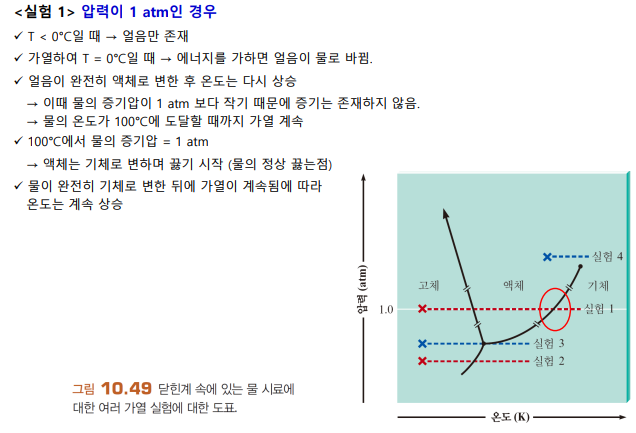
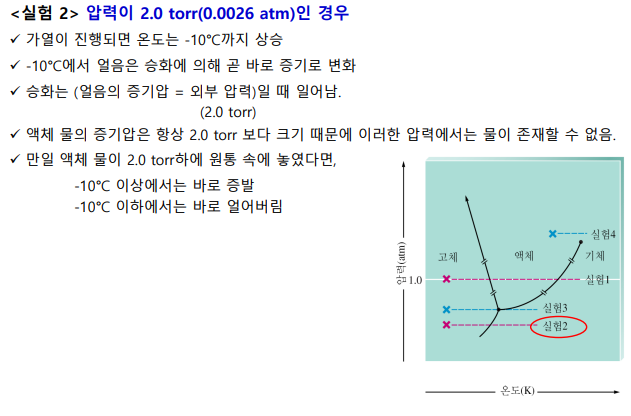
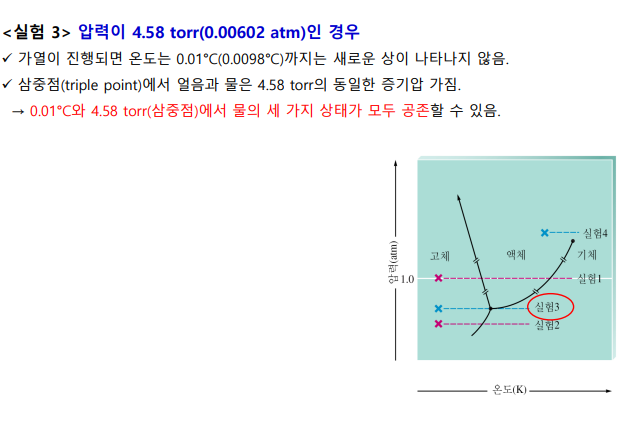
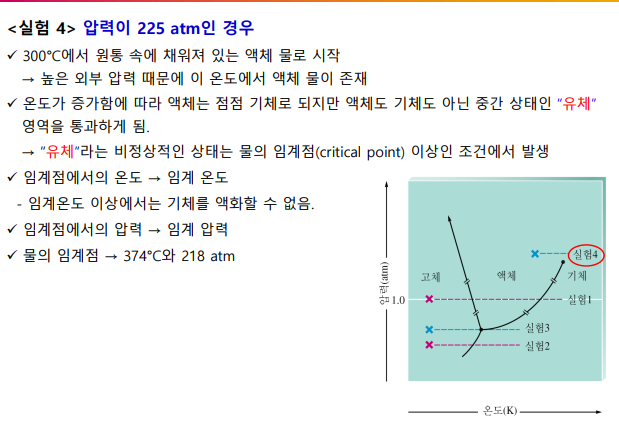
삼중점: 3가지 상태가 모두 가능
임계점: 임계온도, 임계압력 상태. 이 너머는 기체-액체 중간 상태인 유체가 된다
1atm일 때, 선과 만나는 곳이 어는 점, 끓는 점 (두 상이 공존하는 상태)
물과 이산화탄소의 상평형 그림
| 물 | 이산화탄소 - |
| - 고체/액체 경계선이 음의 기울기 얼음의 밀도<물의 밀도라서! 압력이 증가하면 부피가 감소, 액체로 전환 따라서 음의 기울기 압력이 클수록 어는 점이 낮아짐 -압력이 커지면 물의 끓는 점도 높아짐 높은 고도는 낮은 대기압, 낮은 끓는 점  |
- 고체/액체 경계선이 양의 기울기 고체의 밀도>액체의 밀도라서! - 1atm에서 -78도에서 승화 드라이아이스로 쓰임(냉각제) - 증발은 큰 흡열반응 액체가 소화기에서 나오면 바로 기체로 변함 기체가 공기보다 무거워서 산소를 불꽃으롭퉈 차단  |
'일반화학 > 일반화학 개념정리' 카테고리의 다른 글
| <일반 화학> 12장- 화학 반응 속도론 (0) | 2023.09.05 |
|---|---|
| <일반 화학> 11장- 용액의 특성 (0) | 2023.05.30 |
| <일반 화학> 8장 후반~9장- 공유 결합: 오비탈 (1) | 2023.05.19 |
| <일반 화학> 8장- 결합: 일반 개념 -1 (1) | 2023.05.18 |
| <일반 화학> 7장- 원자 구조와 주기성 (0) | 2023.05.14 |





댓글