줌달의 일반화학 10판 정리
11장. 용액의 특성
-용액과 용해도: 조성, 에너지(용해열, 엔트로피), 용해도 영향 3요인(온도, 압력, 구조)
-용액의 특성: 증기압(라울법칙), 총괄성 3가지(삼투압, 끓는점 오름, 어는점 내림), 콜로이드
<용액과 용해도>
용액의 조성
용액=균일 혼합물=용매+용질
ex. 고체, 액체, 기체 뭐가 섞이든... 공기, 탄산수, 보드카(액체+액체), 바닷물(액체+고체) 놋쇠(고체+고체) 등..
*수용액- 물이 물질을 잘 녹임
용액의 조성
| 몰농도(M) | 몰랄농도(molality) | 몰분율(x) | 질량백분율 | ppm,ppb | 노말농도(N) |
| mol(용질)/L(용액) | mol(용질)/kg(용매) | mol/전체mol | (용질질량/용액질량)*100 | g(용질)/10^6용액 g(용질)/10^9용액 |
당량수(용질)/L(용액) |
 |
 |
 |
 |
 |
 |
*당량수
산-염기 반응: 1mol H+ 이온 받고 내놓는 기준
산환-환원 반응: 1mol 전자 받고 내놓는 기준
용액 형성의 에너지
용해열=1+2+3 ΔH
1. 용질의 팽창 - 용질 간 인력 극복 (흡열)
2. 용매의 팽창 - 용매 간 인력 극복 (흡열)
3. 용질-용매 섞임 - 용질-용매 간 인력 (발열)
*수화열=2+3
화학식 표현
1 NaCl(s) → Na+(g) + Cl-(g) ▶격자 에너지의 역반응으로 구할 수 있음 (이온의 인력 척도)
2,3 (수화 엔탈피) Na+(g) + Cl-(g) +H2O(l) → Na+(aq) + Cl-(aq)
1,2,3 (용해열) NaCl(s) → Na+(aq) + Cl-(aq)
무질서도(엔트로피) ΔS
NaCl은 3kJ/mol로 용해열이 양의 값이지만, 잘 녹는다
이유는 무질서도가 증가하기 때문이다
반응에 영향을 주는 요인 (1)엔탈피 ΔH (2)엔트로피 ΔS → 둘을 합친 ΔG
ΔG = ΔH - TΔS



like dissolves like
극성-극성: 인력 큼 / 비극성-비극성: 인력 작음 / 비극성-극성 인력 작음
→ 극성-극성: 1,2 크지만 3이 매우 큰 음의 값 & 무질서도 증가 → 용액 형성
→ 비극성-비극성: 3이 작은 음의 값이지만 1, 2도 작음 & 무질서도 증가 → 용액 형성
→ 극성-비극성: 극성의 1이 큰데 3이 작음 → 용액 형성 안 함
용해도 영향 요인 3가지
| 구조(극성, 비극성) | 압력 *기체만 영향받음 | 온도 *고체는 대체로 증가 *기체는 감소 |
| 극성-극성(친수성) ex. 비타민C: CH 전기음성도 비슷 비극성-비극성(지용성, 소수성) ex.비타민A: OH CO 결합 많음 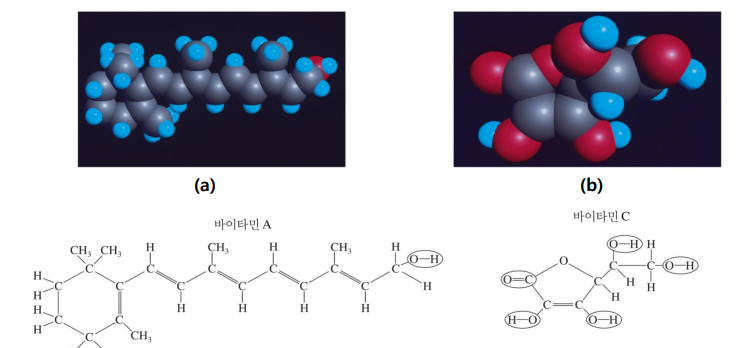 |
압력이 높으면 용해도가 증가함 Henry 법칙 C=kP P- 용액 중 기체용질 분압(atm) C- 용액 기체 농도(mol/L) k- 용액 종류에 따라 달라지는 상수 *용매에서 해리, 반응하지 않을 때 헨리법칙에 잘 맞음 ex. HCl처럼 H+, Cl-(aq) 이온 형태로 잘 녹는 애들은 안 맞음  용액 속 용질-기체 평형상태 압력이 증가하면 용액으로 들어가는 속도 빨라짐 → 새로운 평형(용액 내 기체 증가) |
고체: 대체로 증가 *Na2SO4, Ce2(SO4)3 등은 예외 기체: 온도가 증가하면 용해도가 감소 KE가 증가해 용매-용질 간 인력 극복  *보일러 속 고체 찌꺼기 -가열되면 이산화탄소 줄어듦 -역반응 증가(르 샤틀리에) -탄산이온 증가하며 탄산칼슘 침전 |
헨리법칙 문제

<용액의 성질>
용액의 증기압
비휘발성 용질 용액과 Raoult 법칙
-용질의 영향력: 순수한 용매와 액체 용액의 증기압은 다르다! 증기압이 낮아짐
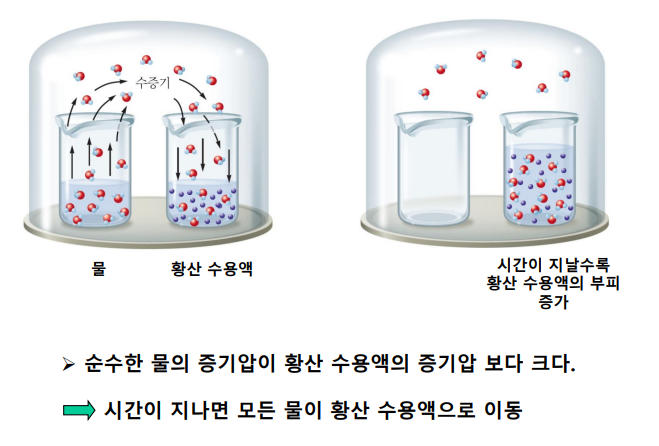
- 물이 증기압이 커서 증기를 내놓음 → 용액의 증기압이 작아서 증기를 흡수함 → 용액만 남아 용액의 증기압으로 평형
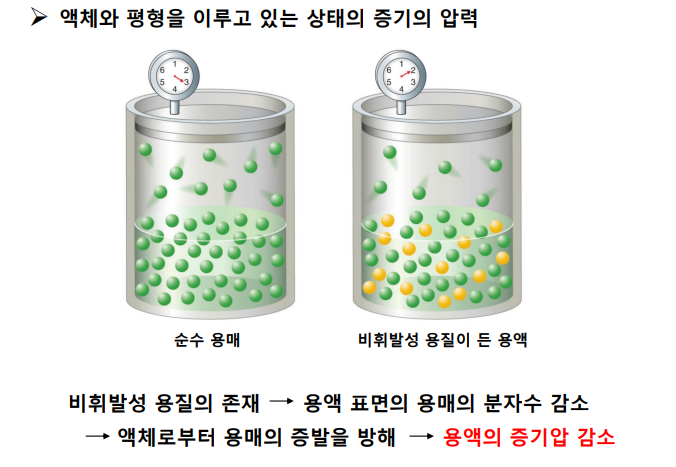
- 비휘발성 용질 → 용액 표면의 용매 분자수 감소 → 용매의 증발 방해 → 용액의 증기압 감소
Raoult의 법칙 (비휘발성 용질)
P용액=x용매P0용매
용액의 증기압(atm)=용매의 몰분율*순수한 용매의 증기압(atm)
비휘발성 용질 용액의 증기압은, 용매의 몰분율에 정비례한다
***Na2SO4 등 이온으로 녹는 애들은 곱하기3 해서.. 구해야!!
*증기압 내림으로 용질 분자량 측정 가능
휘발성 용질 용액(액체-액체 용액)과 이상 용액/비이상 용액
두 성분 모두 휘발성이면, 각각이 증기압에 기여함

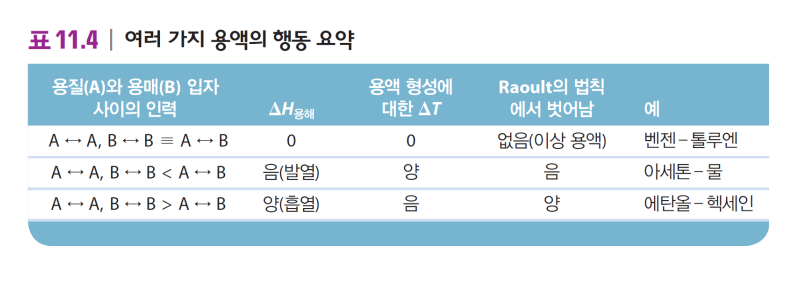
| 이상 용액 -비슷한 성질의 액체로 이루어짐 → (응용된) Raoult 법칙을 만족 |
비이상 용액 -특별한 친화력이 있는 경우 →Raoult 법칙을 벗어남 |
| 용질-용질 / 용매-용매 / 용질-용매 상호작용이 매우 유사함 용매-용질 인력 = 용질-용질 or 용매-용매 인력 ΔH용해=0 P전체=PA+PB=XAP0A+XBP0B  |
* 용매-용질 인력 < 용질-용질 or 용매-용매 인력 → ΔH용해 > 0, 흡열 → 증발하려는 경향(잘 안섞여 있으려 함) → Raoult에서 양의 벗어남 (증기압 높음)  * 용매-용질 인력 > 용질-용질 or 용매-용매 인력 ex. 물과 수소결합하는 acetone → ΔH용해 < 0, 발열 → 증발 안하려 함(섞여 있으려 함) → Raoult에서 음의 벗어남 (증기압 낮음)  |
**[휘발성 용질 용액과 - 물] 2가지 비커 상태? 용질도 증기로 이동해서 두 비커의 농도가 같아지며 평형을 이룸
용질이 물에 비해 덜 휘발적이면, 원래 용액의 부피가 더 클 것임
용액의 총괄성 3 - 끓는점 오름, 어는점 내림, 삼투압
용액의 총괄성: 용질 종류 무관, 용질 입자 개수(몰수)에 의존하는 성질
*분자량 측정에 이용됨
**용매의 종류에는 유관할 수 있음 - Kb, Kf
***이 때 전해질처럼 해리되어 여러 입자로 나뉘어지면 반호프계수 i도 곱해준다
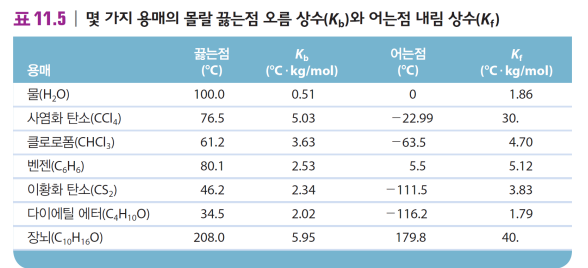
| 끓는점 오름 | 어는점 내림 | 삼투압 |
| ΔT = Kb*m용질 -Kb: 용매 종류에 따라 달라지는 끓는점 오름 상수 -m용질: 용질의 몰랄농도(mol/kg) 끓는점: 증기압이 대기압(1atm)과 같아지는 온도 비휘발성 용잘 → 용매보다 증기압 낮춤 → 더 높은 온도에서 1atm → 끓는점 오름  |
ΔT = Kf*m용질 -Kf: 용매 종류에 따라 달라지는 어는점 내림 상수 -m용질: 용질의 몰랄농도(mol/kg) 용질의 존재가 얼음의 형성을 방해 → 평형이 달라짐 어는점은 물 증기압=얼음증기압 지점 *눈 오는 날 길에 NaCl, CaCl2  |
π = MRT - π=삼투압(atm) - M=용액의 몰농도 (mol/L) - R=기체상수=0.08206 L·atm/K·mol - T=절대온도(K) 반투막: 용매 통과O, 용질 통과X 삼투 현상: 용액 농도가 같아지기 위해 반투막 통해 용매가 용액으로 들어감 삼투압: 용매가 들어가며 생기는 압력=삼투현상을 막기 위한 최소 압력 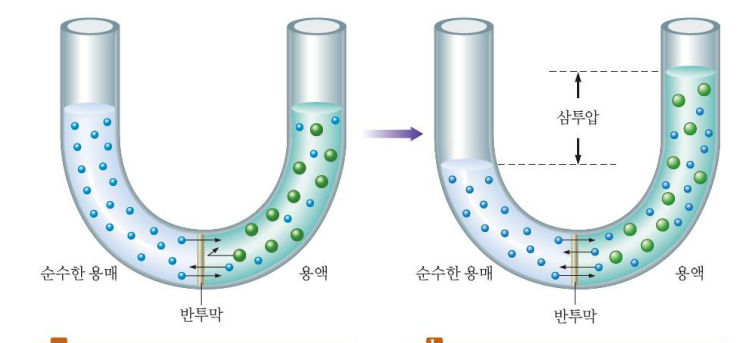 *투석: 용매+작은 용질 분자, 이온 통과 *등장액: 같은 삼투압을 가지는 용액 *역삼투: 삼투압보다 큰 외부 압력을 가해 순수한 용매 얻음 ex. 바다물의 탈 염, 정수기 |
***이 때 전해질처럼 해리되어 여러 입자로 나뉘어지면 반호프계수 i도 곱해준다
콜로이드
콜로이드: 용매(매질)에 작은 입자가 떠다니는 현탁액
정전기적 반발
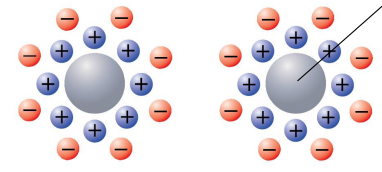
-입자의 중심: 작은 이온성 결정, 분자 집합체, 하나의 커다란 분자 등
-그 주위에 이온층을 끓어들임
-외각층끼리 같은 전하라 반발해 집합체를 만들진 않음
Tyndall 효과 : 콜로이드 입자에 의해 빛이 산란
응집: 열을 가하거나 전해질을 첨가해 콜로이드 파괴, 침전
-가열 → 입자의 속도 빨라짐 → 이온 장벽 뚫는 큰 에너지로 충돌 → 콜로이드 입자의 엉김
-전해질 → 이온 층 중화
'일반화학 > 일반화학 개념정리' 카테고리의 다른 글
| <일반 화학> 13장- 화학 평형 (0) | 2023.09.11 |
|---|---|
| <일반 화학> 12장- 화학 반응 속도론 (0) | 2023.09.05 |
| <일반 화학> 10장- 액체와 고체 (1) | 2023.05.24 |
| <일반 화학> 8장 후반~9장- 공유 결합: 오비탈 (1) | 2023.05.19 |
| <일반 화학> 8장- 결합: 일반 개념 -1 (1) | 2023.05.18 |





댓글