줌달의 일반화학 정리
화학평형의 개념
화학 평형
정반응 속도=역반응 속도 (시간이 지나며 생성물 쌓이니 역반응 속도도 빨라지는.. 속도는 농도에 영향 받는 거 주의!)
반응물과 생성물의 농도가 일정하게 유지되는 상태
동적 평형 (알짜 변화가 없음)


+) 정반응, 역반응 속도가 너무 느려(활성화 에너지가 큼) 평형처럼 보이는 경우도 있으니 주의
ex. 상온에서 N2(g) + 3H2(g) → 2NH3(g)
평형 상수의 개념
-평형상수 K(Kc), 평형위치, 압력평형상수 Kp
(1) 평형상수 K (Kc)
*평형 상수 K (Kc)
K = [C]^l * [D]^m / [A]^j * [B]^k


평형상수 K = 평형식 단위 없음
평형 조건에서 농도는 평형상수(평형식)를 만족한다
질량작용의 법칙
**온도에 따라 다른 값을 가짐
**균형식 계수가 지수가 된다
**속도법칙 k, 지수가 실험적으로 결정되는 것과 헷갈리지 마셈ㅋㅎ
*역반응의 평형상수
K' = 1/K
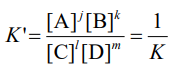
당연히 반응물 생성물이 뒤바뀌니 서로 역수 관계이다
*반응식 계수의 n배일 때 평형상수
K' = K^n
n제곱을 한다
※ 균일 평형과 불균일 평형
균일 평형: 반응물, 생성물이 하나의 상(기체 등)으로만 이루어짐
불균일 평형: 2개 이상의 상으로 이루어짐
불균일 평형에서순수한 액체(l), 고체(s)는 평형과 무관함
농도가 일정하기 때문이다!
→ 평형식, 르샤틀리에 등 죄다 영향을 주지 못한다
평형식에서.. K 자체에 C가 변수가 아닌 상수로서 이미 들어가있다고 해야 하나...
*수용액(aq) 등은 유관함ㅋㅋ
(2) 평형위치
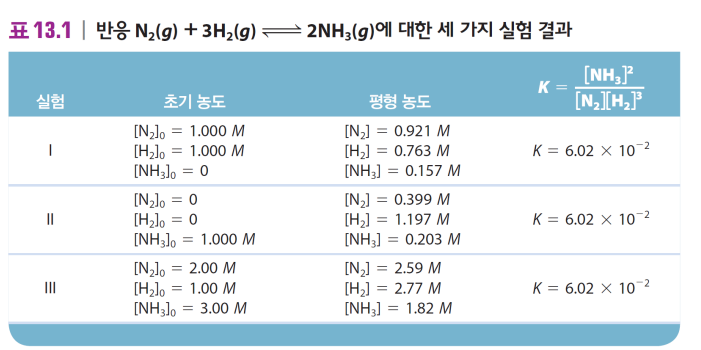
화학 평형에서의 농도 set
평형상수는 하나지만, 평형위치는 다양할 수 있다!
*초기 농도에 따라 달라짐
(3) 부분압력으로 나타낸 평형식 Kp
Kc에서 농도 대신 부분압력을 넣으면 됨
(기체의 농도와 부분압은 비례해서, 유사하게 접근하면 됨)
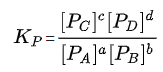
*Kp와 K의 관계
Kp = K*(RT)^Δn
PV=nRT P=RT*(n/V) P=RT*C 를 이용
즉, 둘은 같지 않다 (반응/생성 계수합이 같아 Δn=0 일때만 동일)
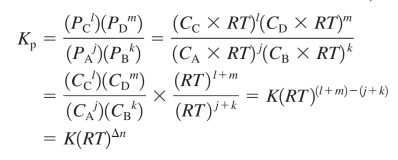
평형 상수의 응용
-반응의 정반응/역반응 치우침 판별 가능
-반응이 앞으로 진행될 경향성 예측 가능 (반응지수Q와 평형상수K 비교)
-주어진 온도/초기농도 조건에서 평형에서의 평형위치(농도) 예측 가능
(1) 정반응/역반응 치우침
=반응의 진행 정도
K >>> 1이면 오른쪽으로 치우침 (평형에서 거의 생성물만 존재)
K <<< 1이면 왼쪽으로 치우침 (평형에서 거의 반응물만 존재)
반응상수 K는 ΔE에 영향을 받음
반응속도는 Ea에 영향을 받고...!
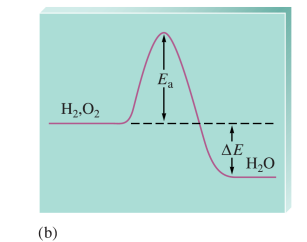
(2) 반응지수 Q → 앞으로의 진행방향 예측
반응지수 Q(Qc) = [C]^l * [D]^m / [A]^j * [B]^k
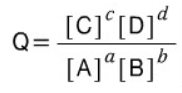
K와 동일하게 구하지만, 꼭 평형 조건이 아니어도 됨!
Q<K 면 오른쪽으로 이동 (반응물이 많은 상태)
Q=K 면 평형
Q>K 면 왼쪽으로 이동 (생성물이 많은 상태)
(3) 평형 농도 예측
해당 온도에서 초기 농도를 보고 평형 농도(평형 상수, 평형 위치 등) 예측하기
1. 균형 맞춘 반응식 쓰기
2. 평형식 K 쓰기
3. 초기 농도를 보고 Q와 K 비교해 방향 결정하기
4. 반응 후 평형 농도를 x와 같은 미지수로 나타내기
5. 평형식에 x 포함한 식 대입해 K와 같다고 두고 x 구하기 → 평형 농도 완성!
이 때 2개 나오면, 평형 시 양수가 나오는 것으로 고른다
6. K 나오는지 보고 검산하기
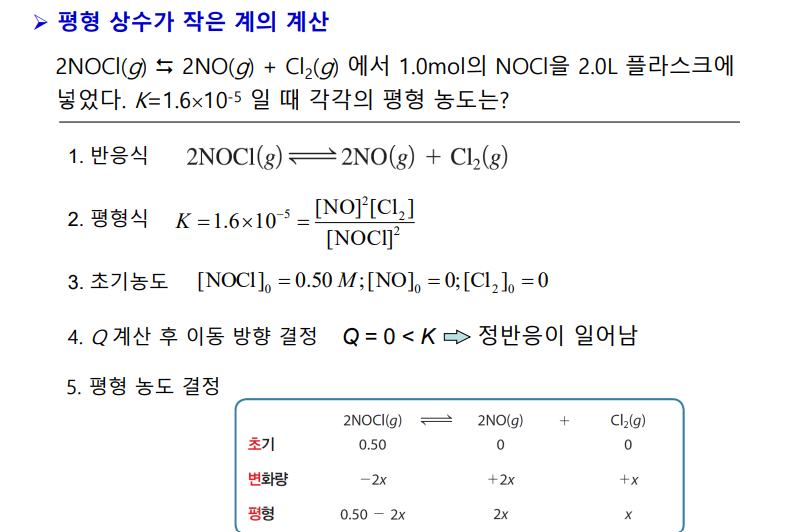
*평형 상수가 작을 때
반응물 초기 농도가 거의 변하지 않으니,
평형 후 반응물 농도를 초기 농도와 같다고 근사해도 좋다
르 샤틀리에의 원리
계에 변화(농도, 압력, 온도) 가해지면, 그걸 감소시키는 방향으로 평형 위치가 이동
*온도는 평형상수까지 이동!
| 농도 | 압력 | 온도 |
| 반응물이나 생성물을 가하거나 줄이면, 이를 되돌리려는 방향으로 평형 이동 반응물 농도 증가 → 정반응 생성물 농도 증가 → 역반응 반응물 농도 감소 → 역반응 생성물 농도 감소 → 정반응 |
(1) 기체 반응물/생성물 첨가 or 제거 농도와 같음 (2) 용기의 부피 줄이기 or 늘리기 농도(n/L)=부분압(P) 증가해 몰수 줄이는 방향으로 반응 진행 ※ 반응에 참여 않는 비활성 기체 첨가 → 아무런 영향을 주지 못 함 - 전체 압력은 높이나, 반응물/생성물의 부분압(n/L)은 변하지 않기 때문 |
발열 반응(<0)이면 온도 높이면 역반응 (E 소비) 온도 낮추면 정반응 (E 방출) 흡열 반응(>0)이면 온도 높이면 정반응 온도 낮추면 역반응 |
| 평형 위치가 변할 뿐! K는 동일 -Q가 변화해서다시 K를 향하려고 하기 때문 ex. 반응물 농도 증가하면 Q<K -분자 충돌수가 증가하기 때문 |
평형 위치가 변할 뿐! K는 동일 -Q가 변화해 다시 K를 향하려고 하기 때문 |
-K 자체가 변화함 열을 하나의 생성물로 취급하면, →열이 늘어나거나 줄면 이를 소비하려는 방향으로 이동하고, →그 결과 농도가 변화해 K값도 변화한다 즉 K에 영향은 안 주지만 생성물로 취급 |
| *** 순수 액체, 고체는 농도가 높아져도 아무 변화 없으니 주의 *** | *** 반응에 참여 않는 비활성 기체는 첨가해도 아무런 영향을 주지 못 함*** - 전체 압력은 높이나, 반응물/생성물의 부분압(n/L)은 변하지 않기 때문 |
농도 예시
압력 예시
온도 예시
'일반화학 > 일반화학 개념정리' 카테고리의 다른 글
| <일반 화학> 15장- 산염기 평형 (0) | 2023.09.24 |
|---|---|
| <일반 화학> 14장- 산과 염기 (1) | 2023.09.18 |
| <일반 화학> 12장- 화학 반응 속도론 (0) | 2023.09.05 |
| <일반 화학> 11장- 용액의 특성 (0) | 2023.05.30 |
| <일반 화학> 10장- 액체와 고체 (1) | 2023.05.24 |
































댓글