줌달의 일반화학 정리
산 염기의 개념
다양한 산 염기의 정의
| 아레니우스 | 브뢴스테드-로우리 | 루이스 |
| 산: 수용액에서 H+ 냄 염기: 수용액에서 OH- 냄 |
산: 양성자(H+) 주개 염기: 양성자 받개  |
산: 전자쌍 받개(빈 원자궤도함수 가짐) 염기: 전자쌍 주개(고립 전자쌍 가짐) |
| 수용액에만 적용 염기 중 OH- 딱 하나만 다룸 |
*기체상태도 적용 가능 |
*금속 양이온 등도 포함 |
루이스 산염기 모형



산과 염기(브뢴스테드-로우리 기준)
| 산 양성자(H+) 주개 |
염기 양성자(H+) 받개 |
HA + H2O(l) -> H3O+ + A- *주의* 이 반응은 HA와 H3O+ 간 H+ 버리기 경쟁 H+에 대한 HA와 A-의 경쟁 이것의 역반응을 염기 수용액의 반응이라 착각 말아 염기 수용액에서는 H3O+가 아닌 H2O와 A-가 반응함 OH-와 A-의 염기력 경쟁임 역반응이 강하다는 건 A-가 H2O보다 강한 염기일 뿐 OH-보다도 센 절대적 강산인지는 알 수 없음 |
B + H2O(l) -> BH+ + OH-  주로 비공유전자쌍이 존재하는.. |
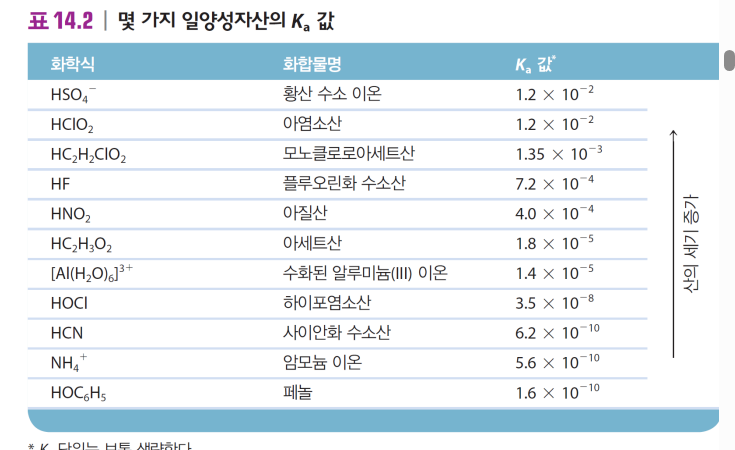
Ka(산해리 상수) = [H+]*[A-]/[HA] Ka가 클수록 해리가 잘 됨 → 강산 강산이면 Ka를 다루지 않음. 너무 HA가 작아서.. >> 짝염기는 Kb가 0일 정도로 염기라 칠 수도 없음 |
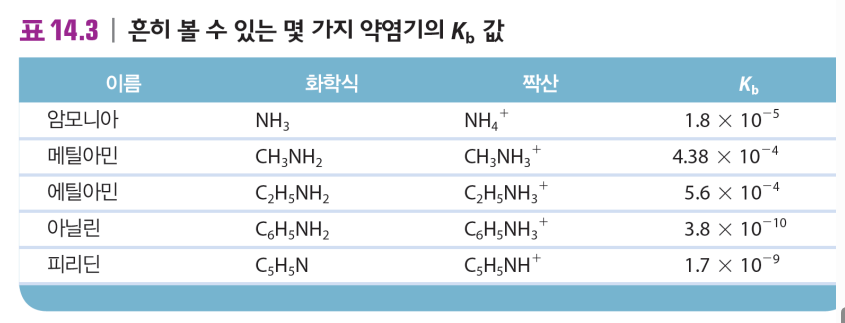
Kb = [BH+]*[OH-]/[B] |
| 강산 *거의 다 해리 됨 [H+]=[HA]0 HCl염산 H2SO4황산 HNO3질산 HClO4염소산 >> 산소산 약산 *별로 해리 안 됨 CH3COOH아세트산 C6H5COOH벤조산 >> 유기산(카복시기 COOH존재) H3PO4인산 HNO2 아질산 >>산소산 |
강염기 1A류: LiOH NaOH KOH RbOH CsOH 2A류: Ca(OH)2, Ba(OH)2, Sr(OH)2 약산 NH3 암모니아 CH3NH2메틸아민 C2H5NH2에틸아민 .. 등 |
| pH = -log[H+] | pOH = -log[OH-] |
산 해리식

약산의 Ka
짝산과 짝염기
*오개념 예방하기 - 산 해리식, 염기 해리식 비교
산 해리식의 역반응은 염기 해리식이 아니다!!!
산 해리식의 역반응은 A-와 H3O+간 반응, 약염기인 H2O(Kw=Kb=10^(-14))와의 경쟁
염기해리식은 A-와 H2O간 반응(수용액), 강염기인 OH-와의 경쟁
>>약산의 짝염기는 H2O보다 센 염기이고 ex. NH3
OH-보다 센 지는 알 수 없다. 절대적인 강염기는 아니라는 것... 아마 더 약할라나?? 그러면 원래 산이 H2O보다도 약한 것이고.. 애초에 산으로 기능을 못할테니.. 그러면 H2O보다는 세고 OH-보다는 약하겠네여..
>>강산의 짝염기는 H2O보다도 약한 염기라고도 부를 수 없는 애다 ex.Cl-
*Ka와 Kb의 관계
Ka*Kb=Kw=1.0*10^(-14)
pKa + pKb = 14
역수 아니다ㅡㅡ 역수는 역반응이고ㅡㅡ
산과 염기로서의 물
물은 매우 약한 산이자 매우 약한 염기인 양쪽성 물질이다
자동이온화 반응, 해리상수
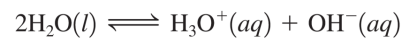

2H2O(l) → H3O+(aq) + OH-(aq)
Kw= [H3O+][OH-]=1.0*10^(-14) **25섭씨도 기준
자체 이온화는 흡열이다.. 25섭씨도 기준임을 기억!

해리 상수의 응용

모든 수용액은 Kw를 만족한다
즉 [H+]와 [OH-]의 곱은 항상 10^(-14) 중성은 둘 다 10^(-7)이 되겠음
이걸로 산성/중성/염기성 판별 가능
pH와 pOH
pH = -log[H+]
pOH = -log[OH-]
pH + pOH = 14
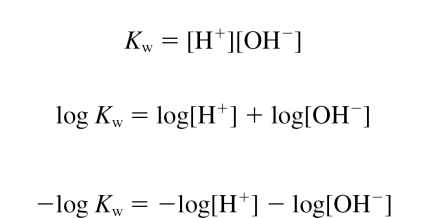
산 염기와 구조
(1) H-X 에서 결합세기와 극성
결합 세기가 약할수록 강산 ex. HF는 강한 결합이라 약산
극성일수록 (H+가 전자쌍을 빼앗길수록) 강산 ex. HCl 극성
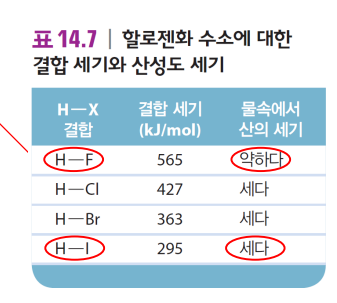
(2) 산소산에서 O의 개수
O의 개수가 많아야 (H+가 전자쌍을 빼앗기고) 강산이 됨

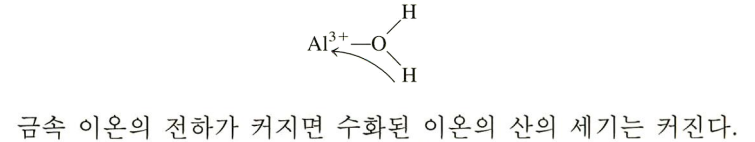
(3) 금속 이온 전하 클수록, 수화된 이온이 강산
전자쌍 많이 당김
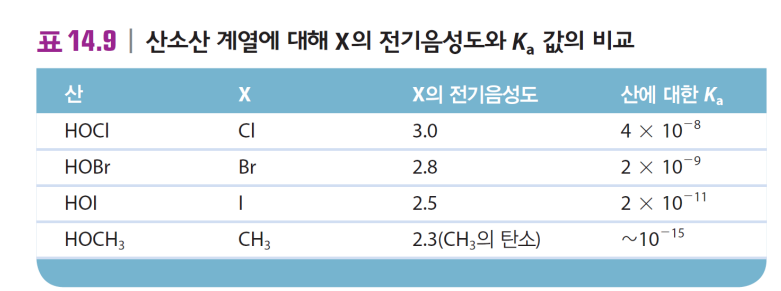
(4) 산소산의 H-O-X에서 X의 전기음성도에 따라 산/염기 결정
-X 전기음성도 큼 > 공유결합st 극성 낮고 결합 셈 > H+로 해리 > 산(강산)
-X 전기음성도 작음 > 이온결합st 극성 높아 잘 해리 > OH-로 해리 > 염기 NaOH KOH
(5) 산화물의 산-염기
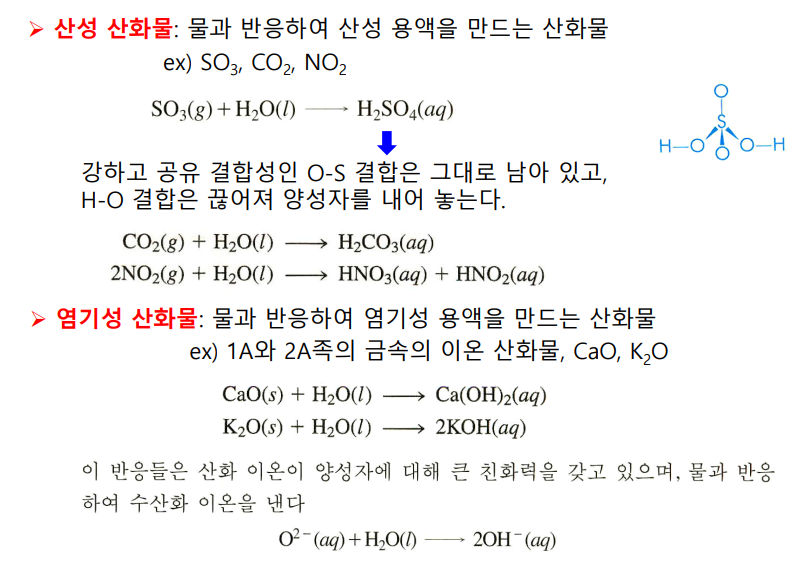
-산성 산화물: 물과 반응해 산성 용액 만듦
H2O랑 합친 후, 기존에 있던 강한 공유결합성은 안 끊기고, H-O 끊겨서 H+만 내놓음
산소랑 공유결합한 SO3 CO2 NO2
-염기성 산화물: 물과 반응해 염기성 용액 만듦
산화 이온이 양성자에 대해 큰 친화력을 가져, 물에서 OH-만 남김
1A, 2A 금속의 산화물 ex. CaO, K2O
산-염기 계산
1. 산 용액, 염기 용액의 pH 계산
(1) 주성분을 쓴다
-센 산/염기면 완전 해리 약한 산/염기면 ㄴㄴ
-주성분 간 반응을 결정한다
(2) 주 H+ 주개/받개를 결정한다
-센 산이면 농도가 너무 낮진 않은지
-약 산이면 농도 외에도.. Kw, Ka들 간 비교하기
(3) 강산이면 초기농도로, 약산이면 Ka를 이용해 [H+] 구하기
-Ka 구할 때 근사법을 쓰고 5% 규칙에 들어 맞는 지 체크
-5%에 안 맞으면 복잡하지만 근의 공식으로 계산..
(4) 염기라면 pOH를 pH로 바꿀 것
센 산/ 센 염기 용액
(1) 주성분을 쓴다
-센 산이면 다 해리 되니 H+ A- H2O 이런 식
(2) 주 H+ 주개 결정
-물도 자동 이온화로 H+를 줄 수 있지만 센산의 해리력이 압도적
-그러나 만약 HA가 애초에 너무 적다면? 그래서 10^(-7)보다도 적은 H+를 뱉으면?
물의 자동 이온화가 주반응이 됨
(3) H+ 농도로 pH 구하기
약산/ 약염기 용액
(1) 주성분을 쓴다
-약산이면 거의 해리 안되니 HA H2O 이런 식
-HA가 H2O와 좀 반응을 하겠군요...
(2) 주 H+ 주개 결정
-HA의 해리 반응 vs H2O의 자동 이온화 반응 Ka 비교
혼합물이면 여러 Ka 중 비교
-둘 중 더 우세한 공급원이 [H+]를 결정한다 (나머지 하나를 르샤틀리에로 더 억제할 것임)
(3) Ka로 [H+] 계산해 pH 구하기
-5% 규칙 주의하며 근사해도 되고..
약산 용액 pH 계


약산 혼합물
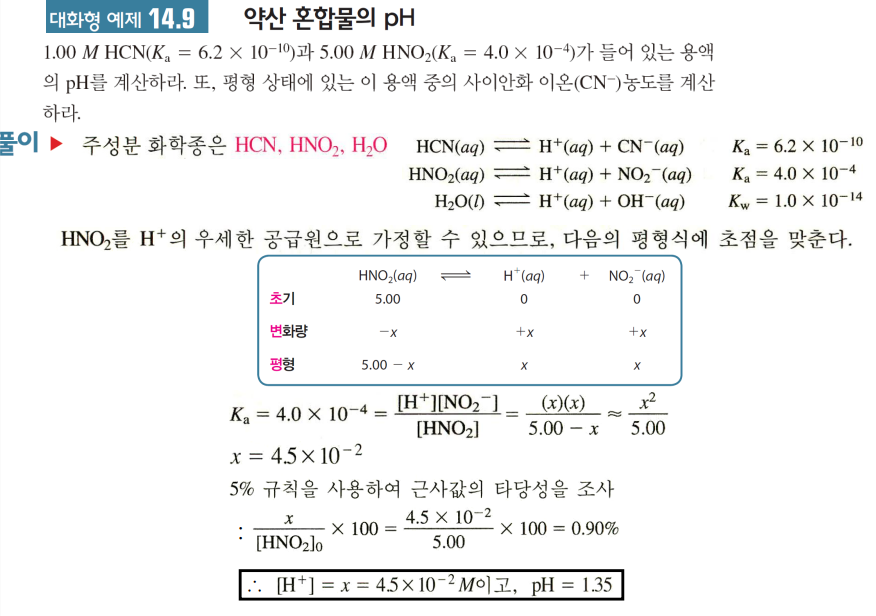

*해리 백분율 유형
해리 백분율=(해리된양/초기농도)*100%

묽어지면서 백분율은 증가함 (당연히 절대적인 양은 줄지만)
해리백분율-Ka 관계 계산 문제

왜 산이 묽을수록 해리백분율이 높냐면


2. 다양성자산 유형
H3PO4인산 H2CO3탄산 H2SO4황산 H2SO3아황산 등...
H2SO4만 강산이고 나머지는 약산
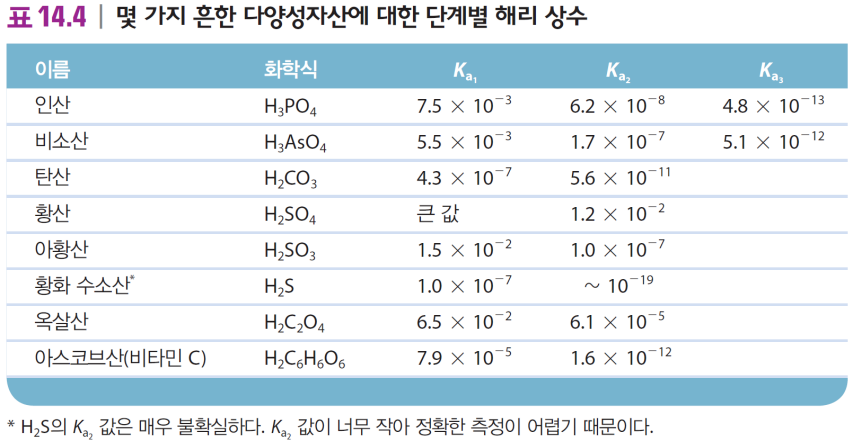
Ka는 갈수록 작아짐. 당연히 음전하가 커지니까!
(1) 주성분 화학종 정하기
-H2SO4만 강산이라 H+, A-, H2O꼴
-그 외는 HA, H2O꼴
(2) Ka1 구하기
-H2SO4는 강산이라 그냥 다 해리 시키고 Ka2로 넘어가셈
(3) Ka2부터는 근사
-훨씬 작기 때문에..
염의 산-염기 성질(예측)
기본 접근
1. 산을 넣으면 산성이고 염기를 넣으면 염기성이다
둘 다 넣으면 더 세고 농도가 커서 많이 해리되는 강력한 녀석으로...
2. 강00의 짝00은 아무 것도 아니다. H2O보다도 약해서 반응 못하는 무반응 녀석
약00의 짝00은 산/염기로서 작용한다. H2O보다 세기 때문
| 강염기의 짝(양이온) + 강산의 짝(음이온) | 중성 양이온에 대한 친화력도 없고 양이온을 뱉지도 못 함 |
KCl NaCl NaNO3 KNO3 |
| 강염기의 짝(양) + 약산의 짝염기(음) | 염기성 염기로 작용하는 애를 넣었으니께.. |
NaC2H3O2 NaF |
| 약염기의 짝산(양) + 강산의 짝(음) 큰 전하의 금속이온(양) + 강산의 짝(음) |
산성 산으로 작용하는 애를 넣었으니께.. **금속 이온은 루이스 산임 H2O와 만나서, 금속의 양전하로 물 분자의 O-H 결합을 분극화 시키고, 물이 H+를 더 잘 뱉게 만든다 >>양전하가 클수록 산 스러움 |
NH4Cl AlCl3 >> Al(H2O)63+ |
| 약염기의 짝산(양) + 약산의 짝염기(음) | Ka > Kb 산성 Ka = Kb 중성 Ka < Kb 염기성 |

'일반화학 > 일반화학 개념정리' 카테고리의 다른 글
| <일반 화학> 16장- 용해도와 착이온 평형 (1) | 2023.10.13 |
|---|---|
| <일반 화학> 15장- 산염기 평형 (0) | 2023.09.24 |
| <일반 화학> 13장- 화학 평형 (0) | 2023.09.11 |
| <일반 화학> 12장- 화학 반응 속도론 (0) | 2023.09.05 |
| <일반 화학> 11장- 용액의 특성 (0) | 2023.05.30 |












댓글