줌달의 일반화학 10판 정리
완충 용액
완충 용액의 개념과 pH
공통 이온 효과: 평형 반응에 이미 포함된 이온(공통이온)을 첨가해 평형의 위치가 이동하는 것


완충용액: OH-, H+ 이온이 첨가되어도 pH 변화를 막는 용액
-약산 + 짝염기의 염 (해리 되면 짝염기) ex, HF와 NaF
-약염기 + 짝산의 염 (해리 되면 짝산) ex. NH3, NH4Cl
* 완충 용액의 pH 계산
(1) 주성분 화학종
(2) Ka에 대입
이 때 약산, 짝염기 넣고 근사해 쉽게 구하는 경우가 대부분...
(애초에 짝염기 때매 반응이 코딱찌만큼 일어남.. 그래서 x가 겁나 작음)
* 완충 용액에 센염기/센산 첨가
(1) 그 농도만큼 약산/짝염기 증가/감소
(2) Ka에 대입해 새로운x(새로운 평형) 구하기
원래 짝염기/약산 비율 → 새 짝염기/약산 비율 변화량이 적을수록 pH도 안 변할 것이다
**Kb면 Ka, pOH면 pH로 바꾸기 주의
완충 작용의 원리, 헨더슨 하셀바흐 식
완충 작용의 원리 & 헨더슨 하셀바흐 식
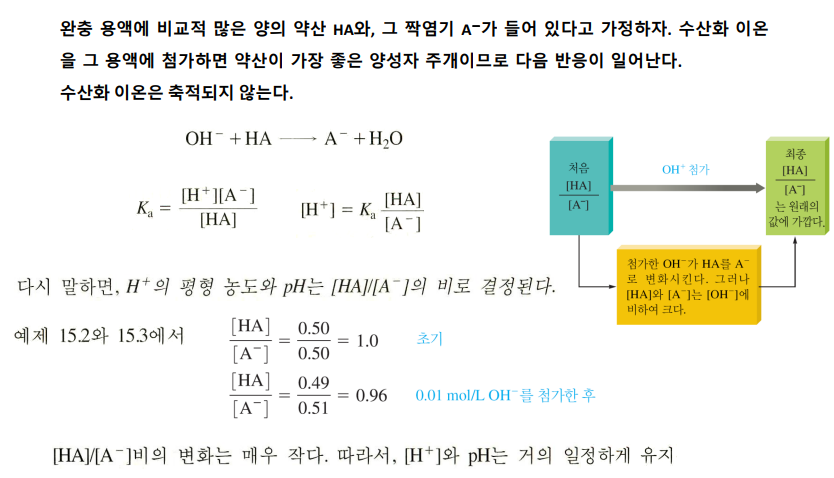

OH- 이온을 넣으면, 가장 좋은 양성자 주개인 약산 HA와 반응한다
OH- + HA -> A- + H2O
따라서 OH-는 A-로 대체 된다. 즉 OH-는 축적되지 않는다.
Ka에 걸맞는 새로운 평형 위치를 가지게 된다. 즉, [H+]가 변하는데...
Ka = [H+][A-]/[HA]
[H+] = Ka*[HA]/[A-]
pH = pKa + log([HA]/[A-]) 헨더슨 하셀바흐 식
여기서 변하는 건 [HA]/[A-]로, 이 비율이 별로 안 바뀌었다면 pH도 별로 안 변한다
주로 OH-는 HA, A-에 비해 아주 조금이기 때문에 비율이 별로 안 변한다
그래서 완충 작용!
헨더슨 하셀바흐 식

***헨더슨 하셀바흐식은 평형 중 [HA]/[A-]를 알 때 pH 계산 시 유용함
***완충 용액처럼 초기 농도와 평형 농도가 거의 같다고 가정할 때 유용
*헨더슨 하셀바흐 식으로 완충용액 pH 구하기
pH = pKa + log([염기]/[산]) 이용.
pKb만 나와 있다면 pKa로 변환 주의!!
완충 용량과 이상적인 완충 용액
- [A-], [HA] 농도 크기가 크다
- [A-]/[HA]=1에 가까울수록 변화가 적어 좋다
- [A-]/[HA]=1일 때, 원하는 pH 값이 pKa와 같은 약산을 고르면 좋다
완충 용량
pH의 큰 변화 없이 완충 용액이 흡수할 수 있는 H+, OH- 이온의 양
[A-], [HA]의 크기로 결정됨!!
그래야 pH를 결정하는 [A-]/[HA]가 잘 안변하기 때문
***pH는 [A-]/[HA]가 결정
***완충 용량은 [A-], [HA] 크기가 결정
[A-]/[HA] = 1이어야 좋음
그래야 하나가 소모되고 하나가 늘어도 비율값이 영향을 덜 받는다
원하는 pH가 pKa인 약산을 고르기
pH = pKa + log([A-]/[HA])
pH = pKa **[A-]/[HA]=1일 때
산-염기 적정
적정과 pH 곡선
*적정: 미지의 용액의 산 염기의 양을 결정하기 위해,
미지의 용액 속 분석 물질이 완전히 소비될 때까지 뷰렛으로 적정시약(농도를 아는 용액)을 가하는 것
*적정 알짜 이온 반응식 : H+(aq) + OH-(aq) → H2O(l)
*pH 곡선 : 적정시약의 양에 따른 분석 용액 pH 함수
M=mol/L=mmol/mL 참고!
*화학량론점(당량점) : 산/염기 몰수가 같아지는 지점
산의 세기가 아닌 양이 결정
강산/염기에서는 pH=7, 약산/염기에서는 그보다 큼/작음(짝염기/산의 영향)
적정할 때 용액 부피 변화하는 것 주의!! 농도 다시 계산해야 한다!!
| 강-강 적정 | 약-강 적정 |
| 족족 반응하고 남는 H+ or OH-가 결정 -당량점 pH=7 |
넣어준 강염기 때문에 약산/짝염기 비율 바뀌어 새 평형위치 가짐 >> 그걸로 Ka 대입해 pH 계산 -당량점 pH 7보다 크거나 작음 -당량점 절반에서 pH=pKa -초~중반은 완충 용액st *당량점은 강산처럼 같은 농도만큼 넣어줬을 때. *당량점 pH는 약산일수록 크다(짝염기가 강함) <강산과 비교> -처음 스타트 pH는 더 높고.. -더 급격히 오르다가(애초에 H+ 양이 적어서 log 변화 속도가 빠름)/ 완만해졌다가(완충)/다시 급격히 오르며/ 당량점 도달 |
 |
   |
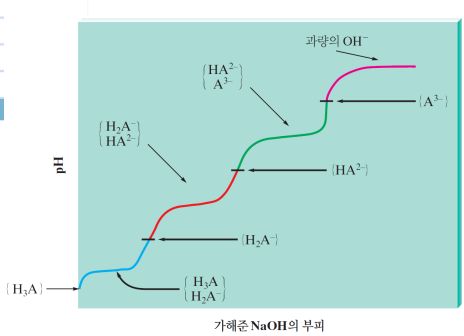
<1> 강산-강염기 적정 / 강염기-강산 적정
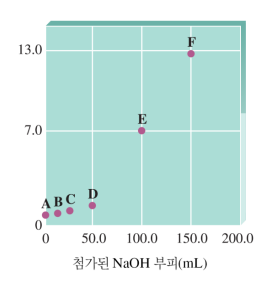
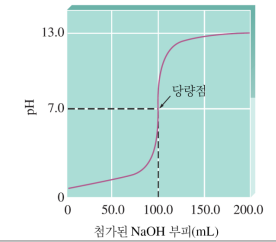
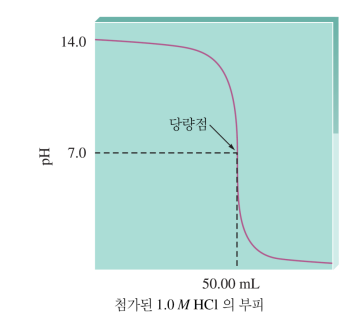
a. 처음엔 H+, A-, H2O 존재. H+에 의해 pH 결정
b. BOH를 넣어줌에 따라 OH-에 의해 H+가 감소해 서서히 pH 높아짐
c. H+가 엄청 조금 남아서 pH가 급격히 높아짐 (100→1 변화보다 1→0.01변화가 쉽다)
d. OH-와 H+가 완전히 반응해 중성!! pH=7.0 당량점=화학량론점
e. BOH를 계속 넣어주면 과량의 OH-가 pOH↔pH 결정, 급격히 증가 (0.00001→0.0001→0.001.. 변화는 급격함)
f. OH-만 겁나 많지만 pOH 자체는 이제 빨리 안 올라 (1→100 변화는 느리다)
<2> 약산-강염기 적정
기본 작용
-약산과 OH-(강염기)는 족족 반응 완결된다.
-남은 산으로 짝염기와의 새 평형위치를 구한다.(pKa 이용)
-그럼 [H+] 농도로 pH를 계산할 수 있다.
*반응 초중반엔 완충 용액에서 완충 작용 계산하는 거랑 비슷하게 하면 됨
OH-와 HA가 반응해서 HA가 줄고 A-가 생겨버림. (기존 코딱찌만큼의 H+는 물론 다 고갈)
마치 완충용액에서 OH-가 A-로 대체되고 HA는 줄어들었듯!
그러면 [HA]/[A-] 비율이 바뀌었었지.. 그래서 HA 해리 반응이 더 일어 나고.. pH가 바뀌는 것까지 고려해 pH 결정
*강산에서는 이미 H+를 내놓았었으니 H+ 자체와 OH-가 반응
또, 기존 산 HA는 이미 H+ 다 내놓았었으니 더 할 해리 반응이X!! 그대로 pH 결정
pH 곡선

☆포인트0. 중간 지점 평평한 pH곡선은, 완충 작용 때문!
급격-평평-급격-<당량점>-급격-평평 **초반 급격한 건 애초에 H+ 양이 적어서 log 변화율이 빠름
☆포인트1. 당량점의 중간 지점에서 pH=pKa
☆포인트2. 당량점에서 pH는 7보다 큼(A-의 염기성)
a. 처음엔 약산 HA의 전형적인 pH 계산. (pKa로 약산 해리반응 x로 잡고 계산한다)
주성분 화학종 HA, H2O
b. 약염기를 넣어주면 OH-가 HA와 반응 주성분 화학종 B+ OH- HA H2O 간 반응 예측하면 그럼
H2O보다는 HA가 센 양성자 주개이기 때문이다 **Ka가 높아서인가? 물도 반응하나 넘 비율적으로 조금 반응해서 무시?
HA + OH- → H2O + A-
[HA] 줄어들고 [A-] 늘었으니 Ka로 새 평형위치 계산 => [H+] 계산 pH 계산
pH가 서서히 높아짐/ 나중엔 급속히 높아짐 (log 특..)
c. [HA]의 절반에 해당하는 BOH 넣으면 pH=pKa HA 중 절반이 해리되어 [HA]=[A-] (산해리 전)
pH = pKa + log([HA]/[A]) = pKa
즉, 당량점의 중간지점에서는 pH=pKa
d. [HA]만큼 BOH 넣으면 당량점이라 HA 소모, A-만 남음
주성분 화학종 A-, H2O, B+
A-는 약염기이니 염기 반응. A- + H2O → HA + OH- **Ka로 Kb 구해 x^2/[A-]..로 계산
약산-강염기 적정에서 당량점 pH는 7보다 높다. 남은 A-가 염기이기 때문
e. 주성분 B+, OH-, H2O, A-
과량의 OH-로 인해 약염기 A- 반응은 억제, OH-가 pH 결정
초반엔 급속히 pH 올라감/ 나중에는 pH 천천히 올라감 (log 특)
약산 적정 pH 구하기
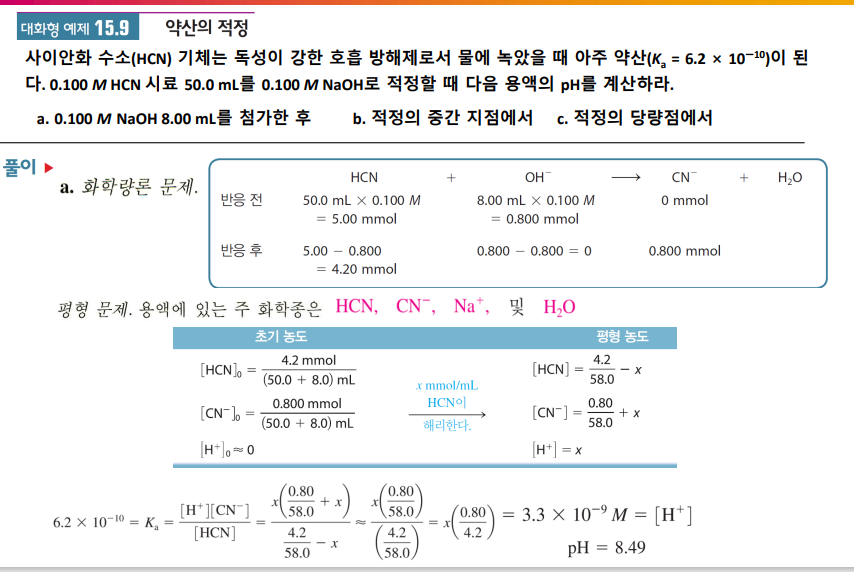


당량점의 특성
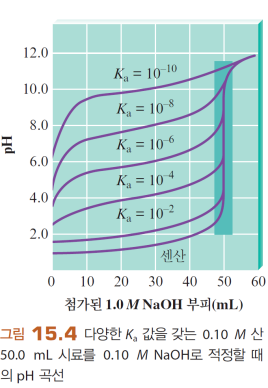
(1) 당량점은 산의 세기가 아닌 양이 결정한다
강산이든 약산이든 당량점은 HA와 같은 농도의 BOH가 가해졌을 때다
(2) 당량점 pH는 산의 세기가 결정한다
약산일수록 pH가 높다 (짝염기의 작용 때매)
그래서 강산은 짝염기가 염기도 아니니.. 걍 7임
>> 적정은 산염기 농도뿐 아니라 약산의 Ka 구할 때도 이용될 수 있다
<3> 약염기-강산 적정
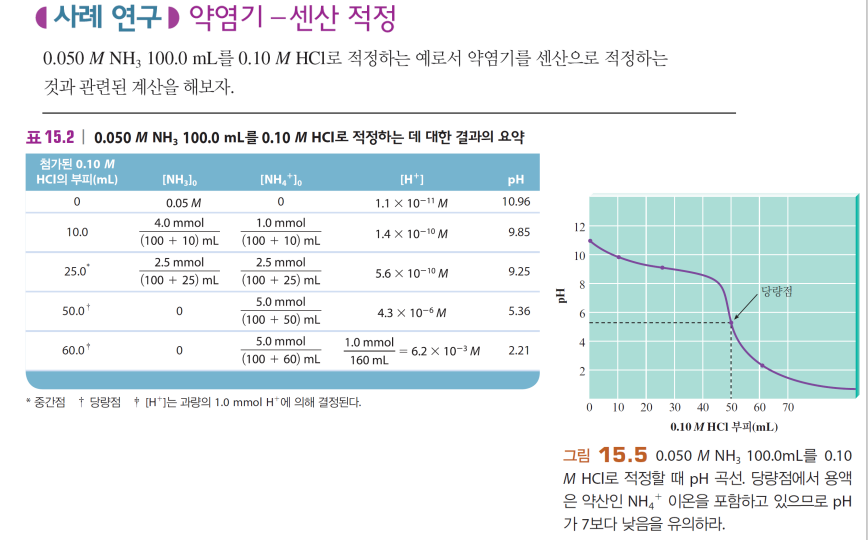
약산-강염기와 비슷함
-초중반에 완충 작용
-당량점의 절반 지점에서 pOH=pKb
-당량점에서 pH가 7보다 낮음 (짝산 B+의 영향)
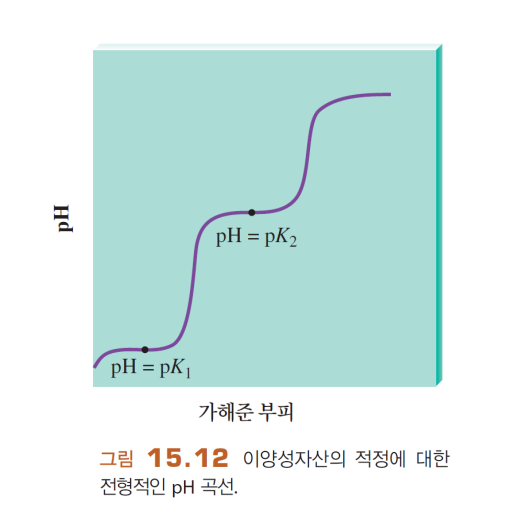
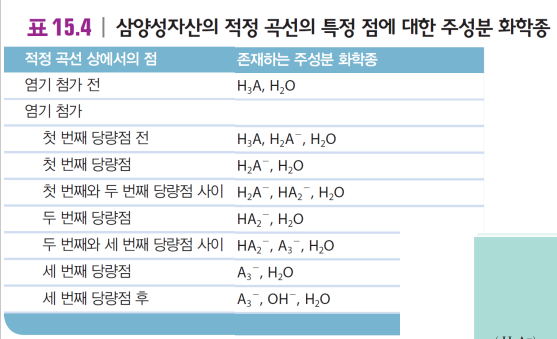
<4> 다양성자산-강염기 적정
여러 번 양성자를 공급 가능함 → n번의 당량점

]
A. H2A 소모될 때까지
a. 평범한 약산 pH
b. OH- 가해지며 급격/완충(당량점반절에서 pH=pKa1)... (새로운 평형 만들어가며 pH 변화)
c. 첫 당량점 도달 >> HA-, Na+, H2O 존재 HA-의 약산 작용으로 pH 7 이하
B. HA- 소모될 때까지
a. 평범한 약산 pH
b. OH- 가해지며 급격/완충(당량점반절에서 pH=pKa2)... (새로운 평형 만들어가며 pH 변화)
c. 두 번째 당량점 도달 >> A2-, Na+, H2O 존재 A2-의 약염기 작용으로 pH 7 이상
C. 과량 OH-에 따라 pH 증가 (급격/완만)
산-염기 지시약
산-염기 적정 당량점(농도 같아지는 지점) 구하는 방법
1. pH 곡선을 그려 수직 영역의 중앙 구하기
2. 산-염기 지시약의 종말점 구하기
종말점: 지시약의 색 변화가 나타나는 지점
당량점과 일치하는 것은 아니다!! 적절한 지시약을 골라야 한다.
산-염기 지시약 (HIn)
자체가 약산(HIn)인 복잡한 분자
양성자가 결합할 때/떨어질 때 서로 다른 색깔을 띤다

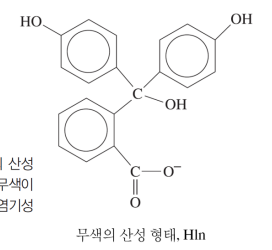
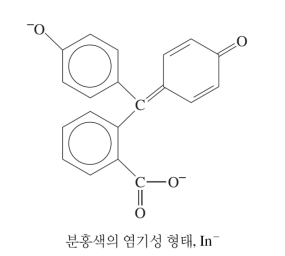
* HIn, In- 평형
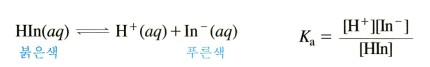
산/염기 용액에서 HIn(aq) ↔ H+(aq) + In-(aq) 의 평형 위치를 이용
-산 용액에서는 르샤틀 때매 역반응 우세해 HIn 형태
-염기성 용액에서는 정반응 우세해 In- 형태인 원리
* 산성도에 따른 [In-]/[HIn] 비율
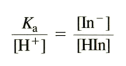
Ka/[H+]=[In-]/[HIn]의 관계이다
색깔 변화는 [In-]/[HIn]=1/10 일 때 나타난다 (색깔 있는 애가 1/10)
색이 두 번 변하면... 1/10 한 번, 10/1 한 번
즉 pH = pKa + 1 or pH = pKa - 1 일 때



* 종말점과 당량점
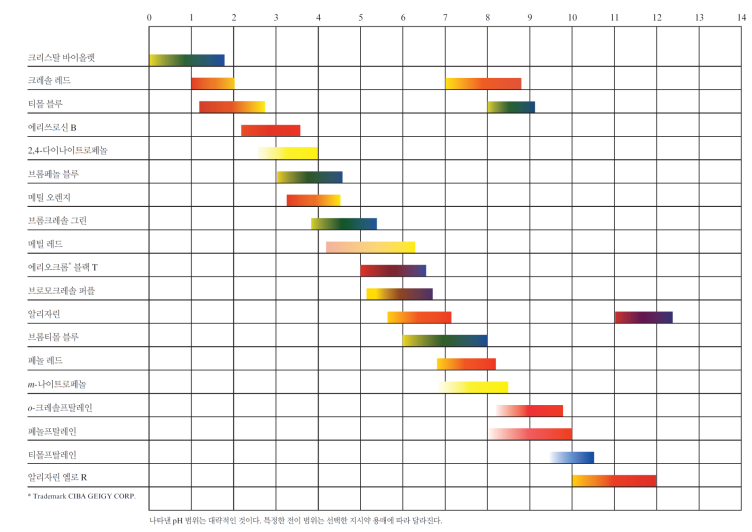
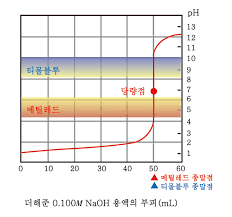
종말점의 pH = pKa +-1인 만큼 Ka에 따라 다양함
당량점에서의 pH와 일치하는 지시약을 잘 골라야 함
-강산: 당량점에서 pH=7 부근으로 pH가 확 변함 >> pKa=8인 지시약 적절
-약산: 당량점에서 각기 다른 pH로 짧은 수직선으로 변함(큰 값으로 변하지 않음)
>> 해당 pH와 최대한 가까운 지식약을 골라야 함
ex. 당량점 pH=8.7이면 종말점(색변화 범위) 8~10인 걸로
그 전이나 후에 바뀌면 무의미할 것..
'일반화학 > 일반화학 개념정리' 카테고리의 다른 글
| <일반 화학> 17장- 자발성, 엔트로피, 자유에너지 (0) | 2023.10.14 |
|---|---|
| <일반 화학> 16장- 용해도와 착이온 평형 (1) | 2023.10.13 |
| <일반 화학> 14장- 산과 염기 (1) | 2023.09.18 |
| <일반 화학> 13장- 화학 평형 (0) | 2023.09.11 |
| <일반 화학> 12장- 화학 반응 속도론 (0) | 2023.09.05 |





















댓글