영상 강의
1. 산과 염기란?
1-1. 브뢴스테드-로우리 vs 루이스
| 브뢴스테드-로우리 산염기 | 루이스 산염기 |
| 브뢴스테드 로우리 산: H+ 주개 브뢴스테드 로우리 염기: H+ 받개 |
루이스 산: 전자쌍 받개 루이스 염기: 전자쌍 주개 *즉, 염기는 줄 고립전자쌍이 있어야 함 |
***루이스 산염기가 브뢴스테드-로우리 산염기를 포함함
(즉, 브->루 / 루o브x도 존재)
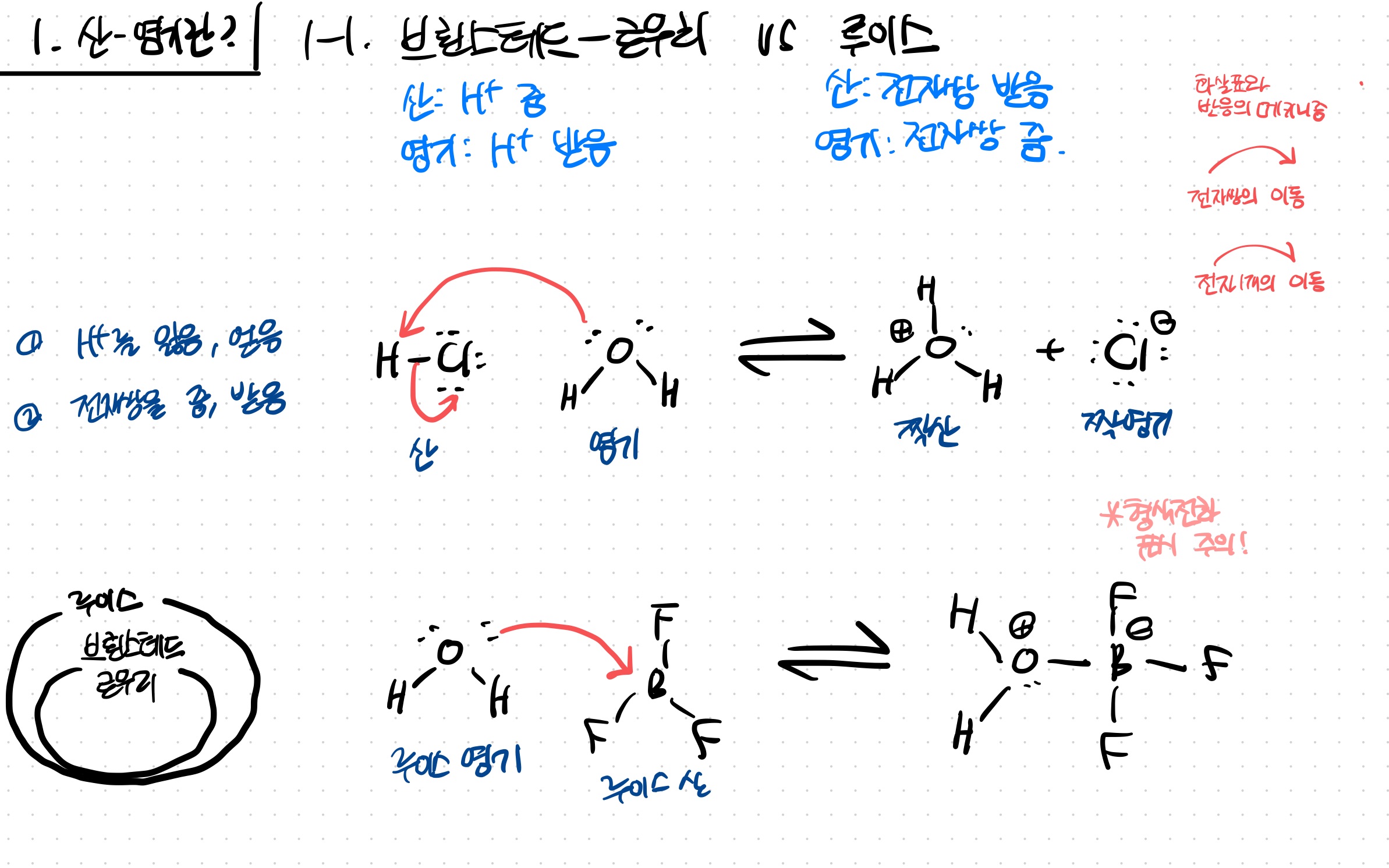
그림에서
위 반응은 양성자를 주고 받는 브뢴스테드-로우리 산염기임
동시에 전자쌍을 주고 받는 루이스 산염기임
아래 반응은 양성자의 이동은 없지만 전자쌍을 주고 받는 루이스 산염기임
(B의 빈 p오비탈에 전자쌍이 들어간다)
*형식전하 표시에 주의할 것
※반응에서의 화살표
유기화학에서는 화살표가 전자의 흐름을 의미한다!
반응의 메커니즘을 나타낼 때 이용한다.
*전자쌍(즉 전자 2개)의 이동 / 전자 1개의 이동은 각각 다른 화살표를 사용한다.
*전자의 시작과 끝을, 화살표의 꼬리 머리로 정확하게 표시해야 한다. 애매하면 안 됨.
*전자쌍, 결합 등의 전자쌍이- 다른 결합이 되거나, 고립전자쌍이 된다
1-2. 짝산과 짝염기

산이 양성자를 잃은 형태가 짝염기
염기가 양성자를 받은 형태가 짝산
산이 강하면 짝염기가 약하다
(= 산이 약하면 짝염기가 강하고.. = 염기가 강하면 짝산이 약하고.. = 염기가 약하면 짝산이 강하고..)
생각해보면 간단하다.
강산이 불안정해서(강해서) H+를 잃고 싶어한다.
H+를 잃어야 안정하기 때문이다.
즉 H+를 잃은 짝염기는 안정한(약한) 약염기이다.
일반화학에서 pKa + pKb = 14.00도 같은 맥락
2. 산의 산성도 판단하기(강산, 약산 / 약염기, 강염기)
산이 강하다는 것은 양성자를 잃고 싶어 한다는 것이다.
염기가 강하다는 것은 양성자를 받고 싶어 한다는 것이다.
이러한 산과 염기의 세기를 판단하기 위한 3가지 방법이 있다.
| 정량적 방법 | 정성적 방법 | ***대략적인 pKa 순서 외우기 |
| pKa가 낮을수록 강산 |
짝염기가 안정할수록 강산 (ARIO) |
ARIO에 기반해서 대략적인 분자들의 pKa 순서를 외움 많이 공부하다 보면 외워짐 |
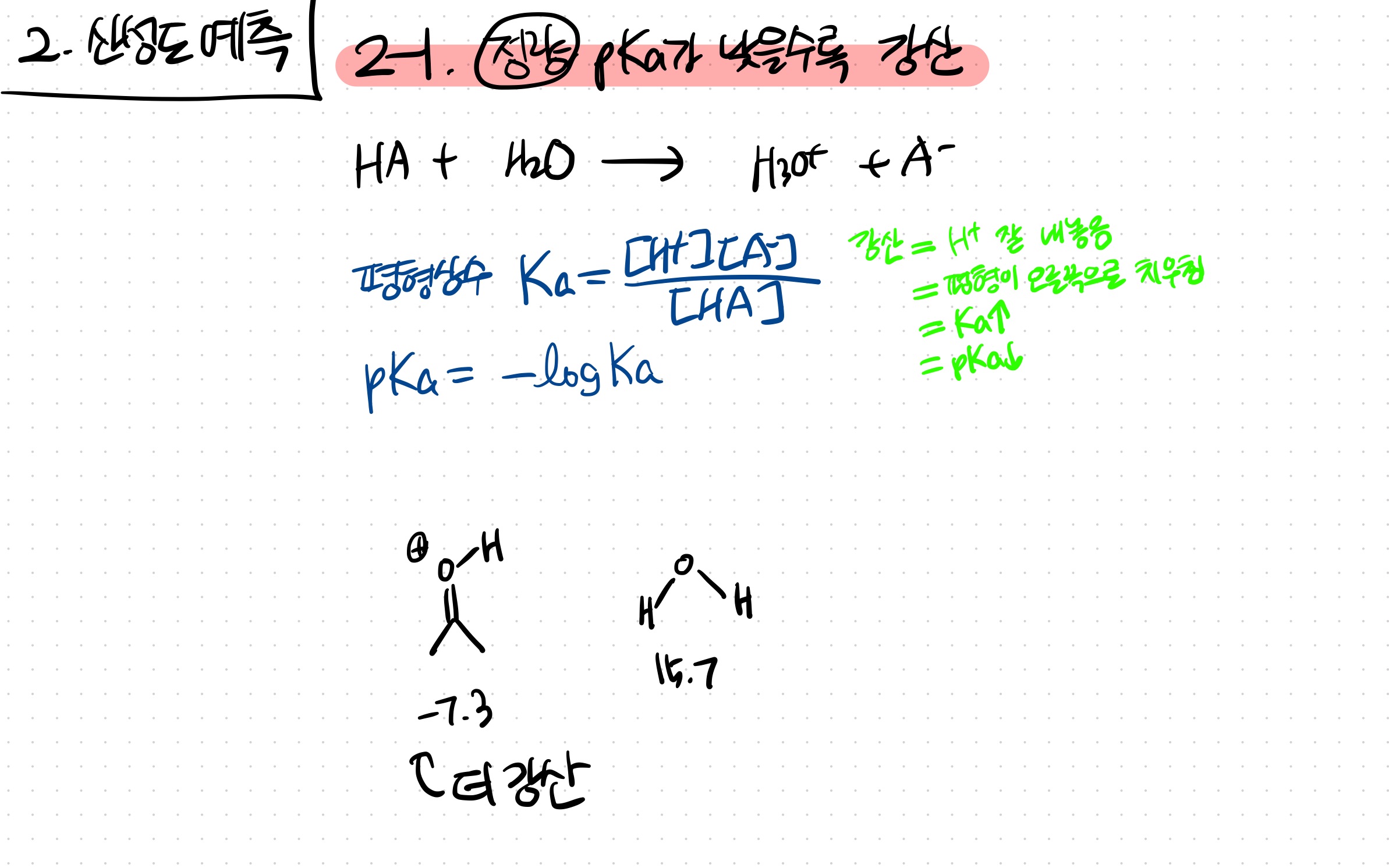
2-1. 정량적 방법 : pKa가 낮을수록 강산
단순히 pKa를 비교했을 때, pKa가 낮으면 강산이다.
*응용해서, 짝산의 pKa가 낮으면 약염기이다
강산이다
=양성자를 잘 내놓는다
=평형이 오른쪽으로 치우친다
=Ka가 높다
=pKa가 낮다
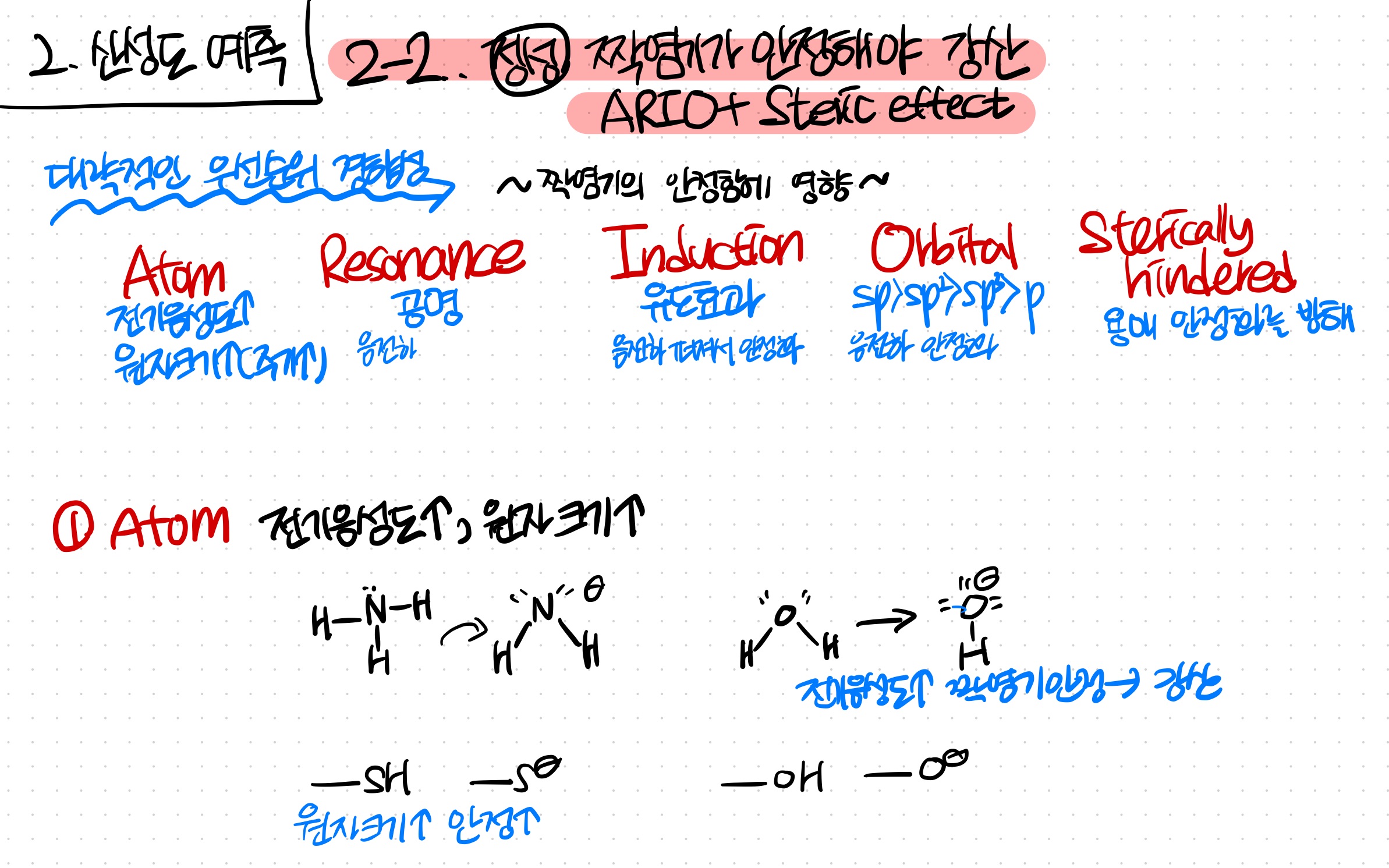
2-2. 정성적 방법 : ARIO + Sterically hindered
짝염기가 안정할면 강산이다.
짝염기가 안정한지 정성적으로 분석하면, 산성도를 알 수 있다.
A > R > I > O > S 의 우선순위로 안정성을 비교한다
대략적인 경향성이지 절대적인 순서는 아님 주의!!
-Atom: 원자 크기가 클수록 & 전기음성도가 클수록 안정하다
*공명 후까지 생각해서, 전자가 퍼져있는 원자들을 파악 후 비교해야 함
-Resonance: 공명이 많을수록 안정하다
-Induction: 전기음성도가 큰 인접한 원자에 의해, 전자가 당겨져 안정화된다
-Orbital: sp > sp2 > sp3 > p 순으로 음전하를 안정화한다
-Sterically hindered: 입체적으로 크면, 용매에 의한 안정화를 방해해 불안정해진다.
1. Atom
원자 크기가 크면, 그 만큼 전자를 잘 안정시킴 = 안정
S vs O : S가 더 주기가 높고, 크기가 커서, 전자를 잘 안정 = 약염기 & 강산
전기음성도가 크면, 그 만큼 전자를 잘 가지고 있음 = 안정
N vs O : O가 더 전기음성도가 커서, 전자를 잘 가짐 = 약염기 & 강산
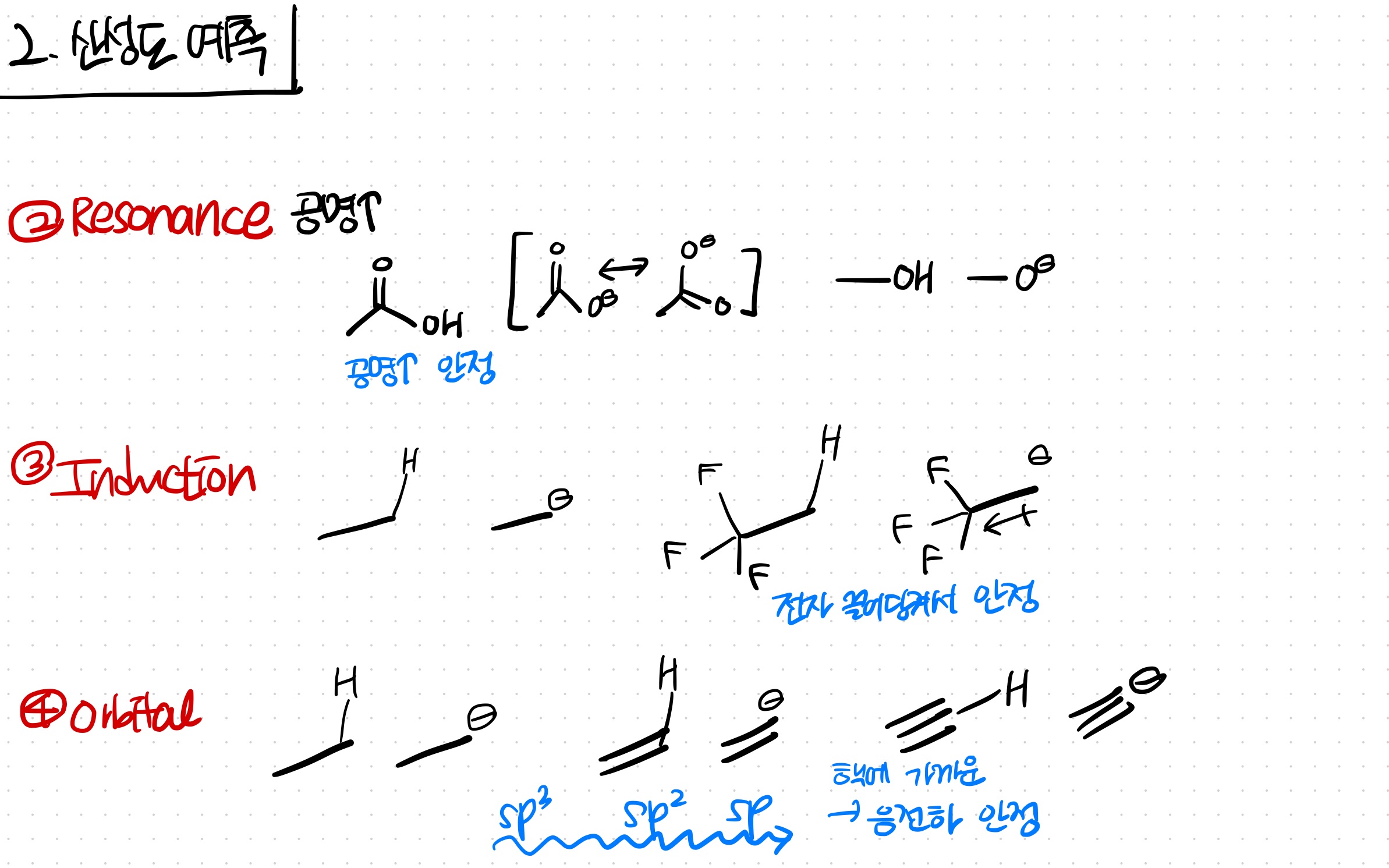
2. Resonance
공명이 많을수록, 유리한 원자에 있을수록 안정하다.
3. Induction
인접한 위치에 전기음성도가 큰 원자가 많을수록,
전자를 끌어당겨 안정해진다
4. Orbital
sp > sp2 > sp3 > p 순으로,
에너지가 낮으니 전자를 잘 안정화시킴
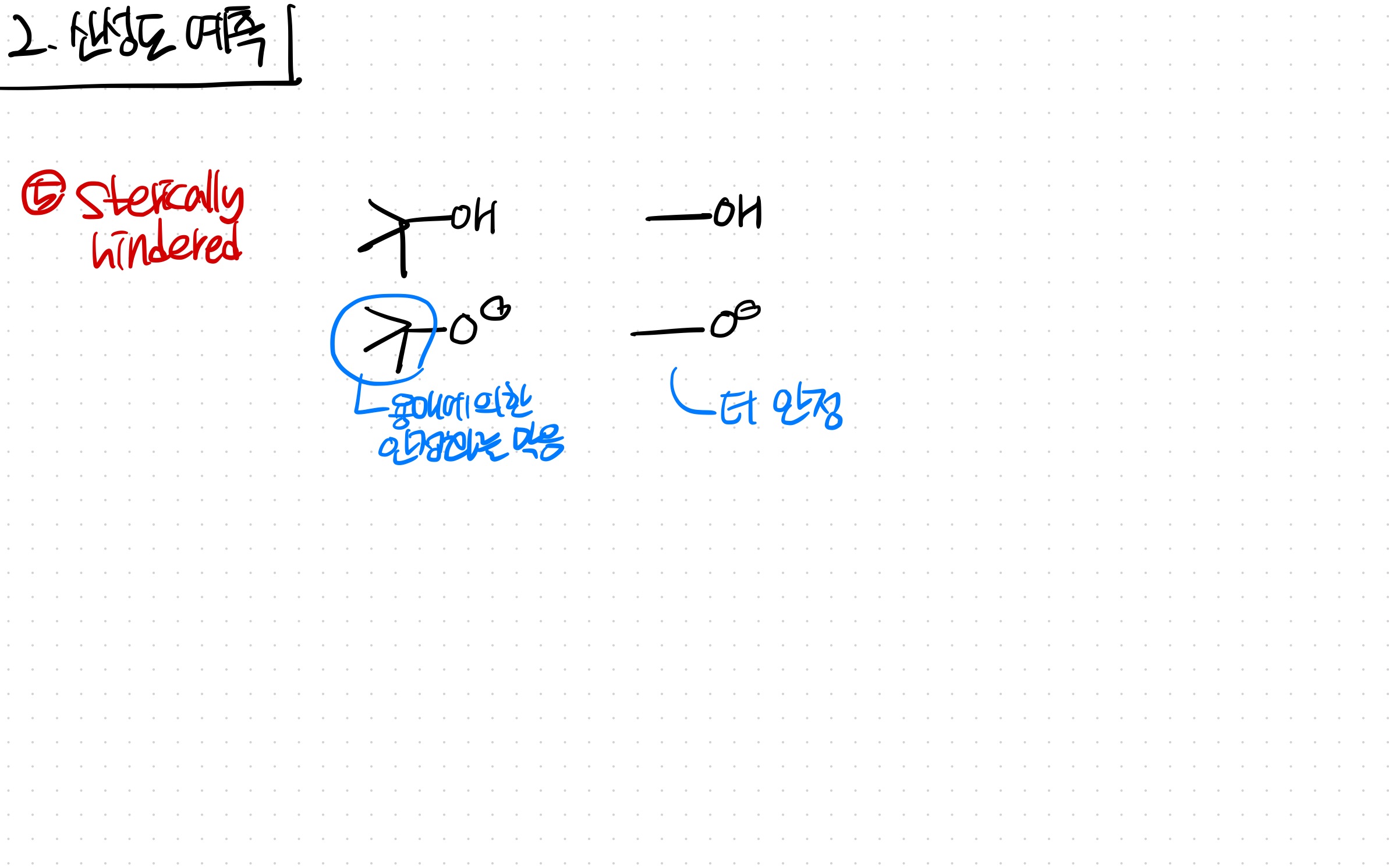
5. Sterically hindered
입체적으로 방해될수록, 용매에 의해 안정화되는 걸 막아 불안정해짐
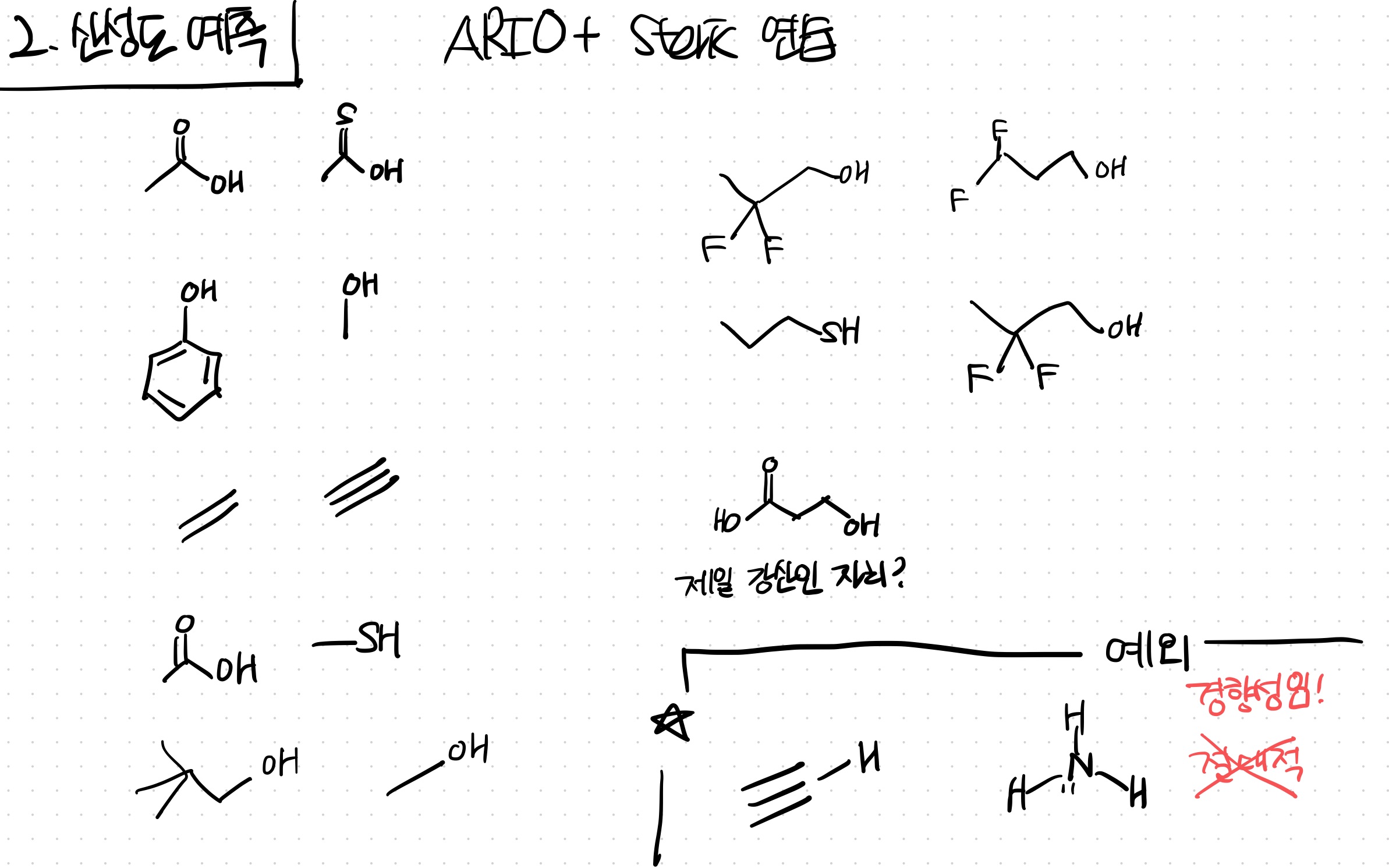
예외: NH3 vs C2H2
C2H2의 sp 오비탈 효과가, C vs N의 atom 효과를 넘을만큼 강력하다
그래서 C2H2가 더 강산이다
2-3. 공부하다 보면.... : 대략적인 pKa 순서 외우기
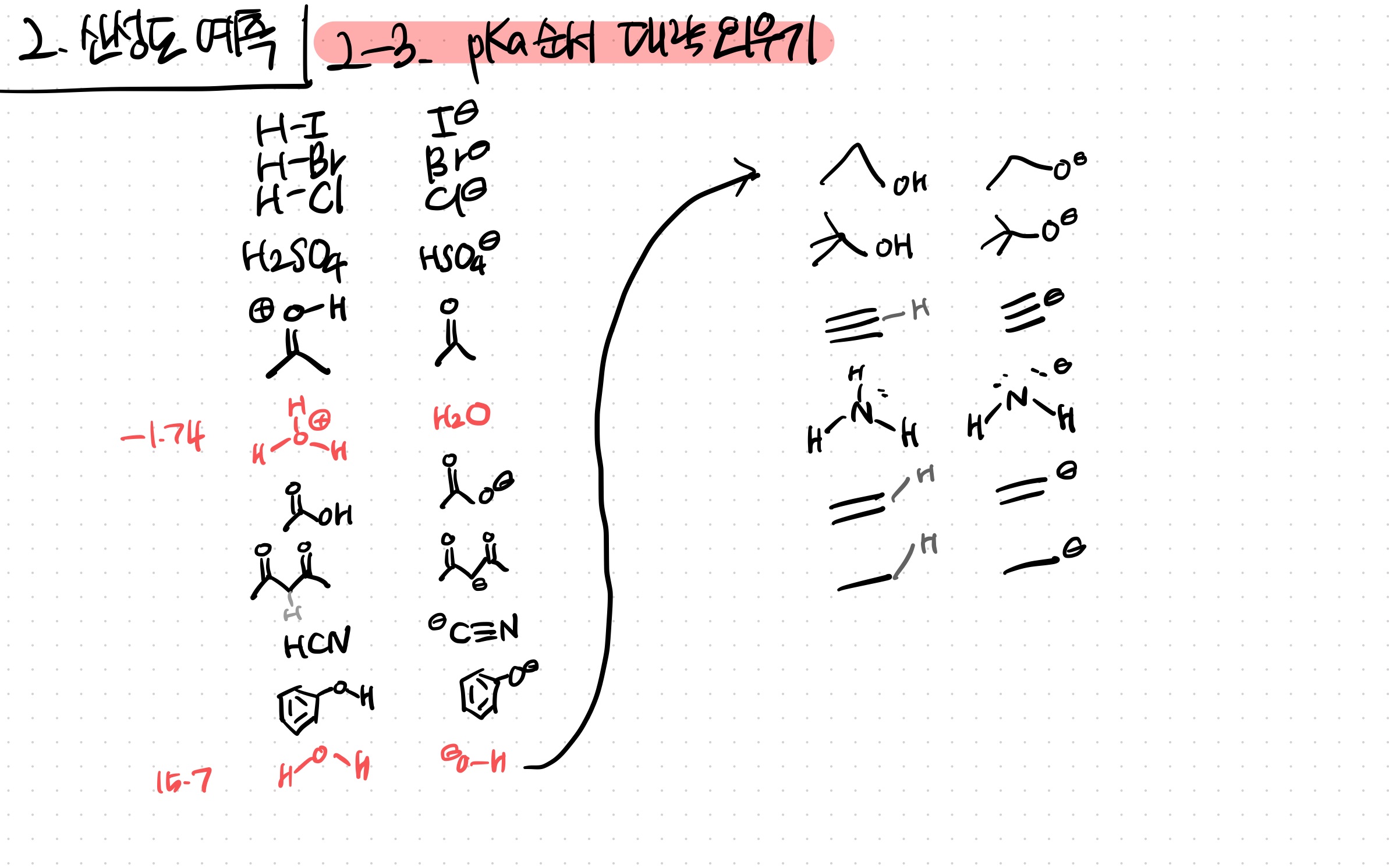
문제 풀다보면 대략적인 순서가 외워진다.
대충 ARIO steric 경향성을 따른다
I- Br- Cl-: 옥텟 만족 굿
H2SO4: 공명이 강력함
oxonium: O에 달린 양성자에, 짝염기가 중성이고 안정
---H3O+---
원자 & 공명에 따른 경향성
---H2O ----
OH류 : steric 경향성
CH류: sp sp2 sp3 오비탈 경향성
그 사이에 예외로 NH3 끼었음
3. 산과 염기로 반응을 분석하기
3-1. 반응의 평형 결정하기
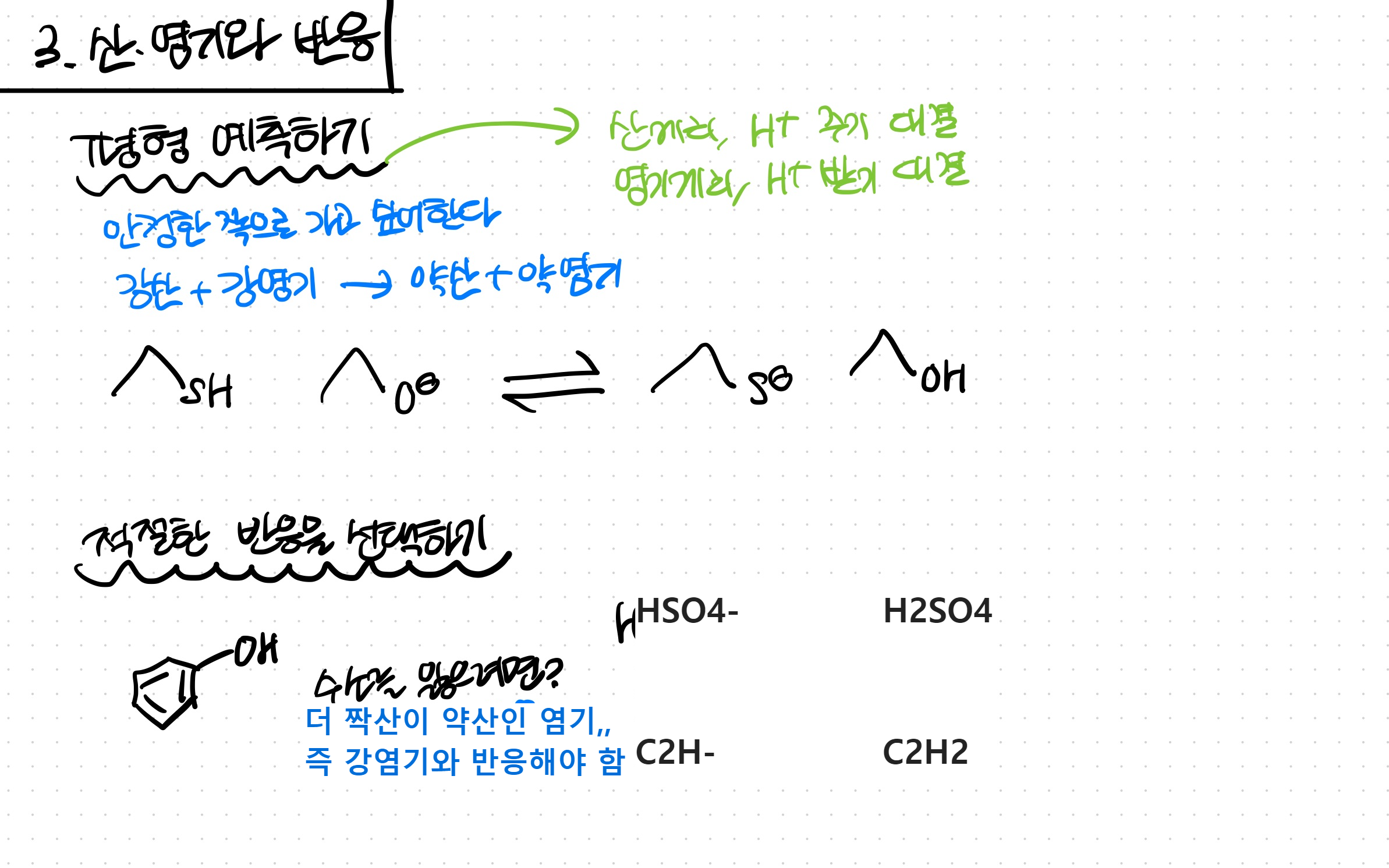
산염기 반응은, 산끼리 양성자를 누가 뱉을지 / 염기끼리 양성자를 누가 뱉을지 대결하는 것과도 같다.
산과 짝염기, 염기과 짝산 간 경쟁이 아니라
산끼리, 염기끼리 경쟁하는 셈!
오개념에 유의.
그렇게 했을 때, 결국 약산, 약염기 쪽으로 평형이 치우치게 된다.
(산성도는 2에서 배운 대로 비교하면 됨)
3-2. 시약 결정하기
반응이 일어나려면, 그 결과 더 안정해지도록 평형이 이루어져야 함.
ex. 산이 반응하려면, 강한 염기 = 짝산이 더 약산인 염기 가 필요
ex. 반대로 염기가 반응하려면, 강산 = 짝염기가 더 약염기인 산 이 필요
3-3. 용매 결정하기 (Leveling Effect)

<Leveling Effect>
반응에서의 용매가
산보다 강산이거나, 염기보다 강염기면 안 됨.
그러면 걔네가 반응물보다 더 격렬하게 반응해서, 원하는 반응이 일어나기 힘듦
*추가적으로 극성 용매를 선택해야, 산 염기가 잘 녹아있음
저 표를 보면, 반응의 산보다 약산이고, 염기보다 약염기인 연두색들이 용매가 될 수 있음.
'유기화학' 카테고리의 다른 글
| [유기 화학] 4. 입체화학, 이성질체 - 구조이성질체, 입체이성질체(거울쌍이성질체, 부분입체이성질체) (2) | 2024.07.18 |
|---|---|
| [유기 화학] 3. 알케인 (Alkane) (2) | 2024.07.16 |
| [유기 화학] 1-3. 공명(resonance) (0) | 2024.06.29 |
| [유기 화학] 1-2. 작용기(Functional Group) (0) | 2024.06.28 |
| [유기화학] 1-1. 골격구조식(bond-line structure), wedge&dash (0) | 2024.06.28 |




댓글