줌달의 일반화학 10판 정리
-흐름-
전체 포괄
1A 수소
2A
3A
4A
5A 질소 인
6A 산소 황
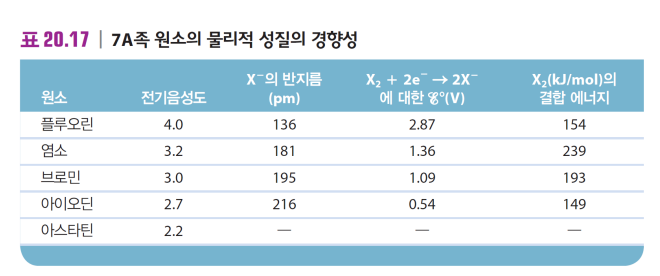
7A *할로젠 원소
8A
<주족 원소의 탐색>
| 주족원소 (1A-8A) | 전이금속 | 란타넘족&악티넘족 |
| s,p | d | 4f, 5f |
| 금속 | 준금속(반금속) | 비금속 |
| 양이온 되려 함(전자잃) *같은 족이면 주기가 아래로 갈수록 금속성 증가 |
금/비 양쪽 B Si 그 뒤는 양쪽 |
음이온 되려 함(전자얻) |
-반지름: 아래(껍질 많음), 왼(유효핵전하 갈수록 증가)가 큼


원소의 분포
지각/해양/대기 - O Si Al Fe...가 많음. 대부분 결합상태(ex. O2보다 Fe2O3)
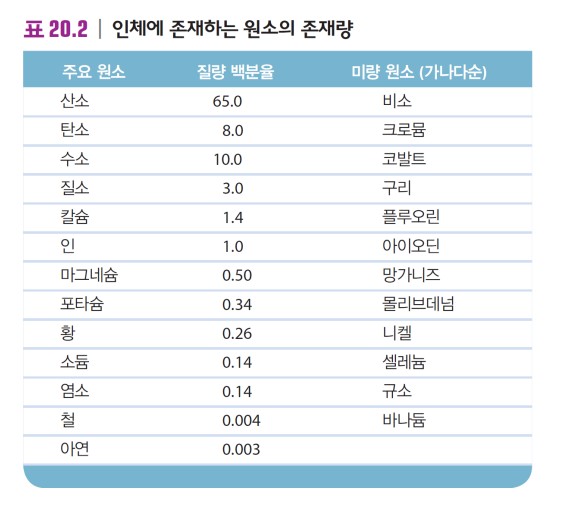
인체 - O C H N..

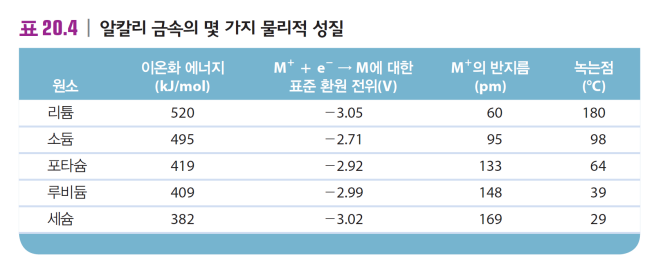
*이온화에너지: 전자 떼어내는 에너지 끼긱 끼기긱 끼기긱
*표준환원전위: 환원될 때..
*녹는점/어는점: 물질 간(내X) 인력(이온결합/수소 결합/쌍극자-쌍극자/분산력)이 클수록 높다
| 1A(ns1) H, 알칼리 금속 |
2A(ns2) 알칼리토금속 |
| -반응성 큼(전자 잃) -알칼리금속+물 → 수소기체  |
-반응성 큼(전자잃 M2+), 이온성 화합물 형성 -알칼리토금속+물 → 수소기체 -산화물이 염기성 **예외로 BeO는 약산성  |
 |
이온교환: 말 그대로 양이온 간 교환 이온교환수지 - 많은 이온성 자리 가짐! ex. 지하수에서 이온교환수지로 무기물 제거하기  |
*Na이 물과 격렬히 반응.. |
*칼슘이 물과 반응해 수소기체 형성 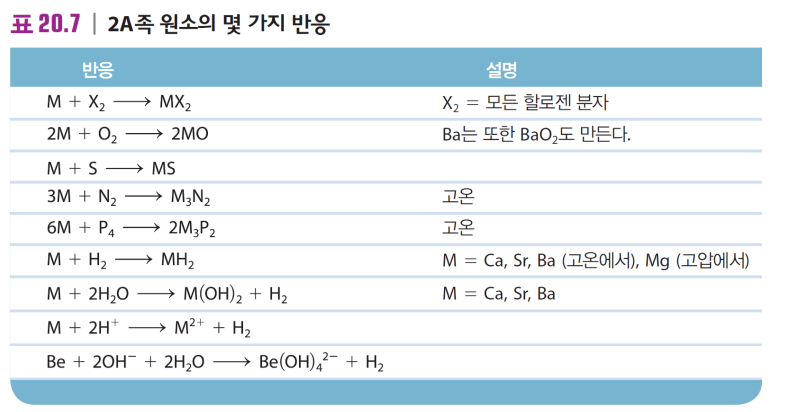 |
1A- 수소
무색무취 기체 H2
작은 몰질량, 비극성 → 끓는점, 녹는점 낮음
18~60% 수소 부피미 공기혼합물은 폭발성
CH4(메테인) + H2O → CO + 3H2
H2O
수소결합으로 물의 밀도가 비교적 큼. 얼음에서는 빈 공간이 생김

수소화물(수소 함유 이성분 화합물)
이온성, 공유결합성 모두 가능
| 이온성 수소화물 | 공유결합성 수소화물 |
| 수소+반응성큰금속 LiH, CaH2 |
수소+비금속 H2O, CH4, NH3 |
| 물과 격렬히 반응해 수소 발생 |
| 3A(ns2np1) B |
4A(ns2np2) C, Si |
5A(ns2np3) N, P |
-아래로 갈수록 금속성 증가 |
-아래로 갈수록 금속성 증가 -4개의 공유결합 with 비금속 CH4 SiF4 GeBr4 **C는 생명구성, SI는 지질계(실리카, 규산염)/반도체구성 게르마늄도 반도체 |
-아래로 갈수록 금속성 증가 -현저히 다른 화학적 성질..?!  |
 |
 |
  |
 |
 |
3A - B 붕소(boron)
BH3는 불안정해서 별로 없고 diborane인 B2H6이 많음

5A - N 질소
N2
매우 강한 3중결합(941kJ/mol)
→ 다른 원소와 반응성X, 안정 ▷ 산소나 물에 민감한 물질 취급할 때 비활성 조건으로 활용
→ 질소화합물 분해해 질소를 만들면 발열반응 (선호 됨)


폭발적인 질소화합물
니트로글리세린(다이너마이트), 트라이니트로톨루엔(TNT)
적은 mol수에서 많은 mol수 나와 갑작스러운 압력증가, 충격파

질소고정&질소순환
질소고정: N2를 질소화합물로 바꿈
질소순환: N2를 질소화합물로 바꿨다가 다시 N2로 돌아왔다가... 그런 자연계의 순환!
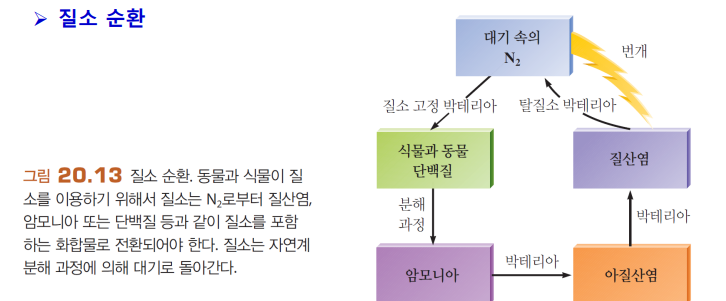
하버공정
질소순환의 일종
암모니아 제조해 비료로

질소화합물-질소의 수소화물, 질소의 산화물
| 질소의 수소화물 | 질소의 산화물 |
| (1) 암모니아 NH3 -독성, 무색, 자극성 가스 -비료 (2) 하이드라진 N2H4 -무색, 암모니아 냄새 액체 -강한수소결합!! 그래서 작은분자량(32)이지만, 높은끓는점(113.5) -로켓추진제, 플라스틱 제조, 농업용 살충제 (3) 모노메틸하이드라진 N2H3(CH3) -로켓연료 |
'산화물'에서 질소의 산화상태는 +1~+5 그 외에서는 -1~-3 (1) 일산화 아질소 N2O -치과마취제 -토양미생물에 의해 생성되어 지구 온도 조절 -휘핑크림 에어로솔 (2) 일산화질소 NO (3) 삼산화이질소 N2O3 (4) 이산화질소 NO2 (5) 질산 HNO3 -질소의 산소산 -폭약, 비료(질산암모늄) 등 제조에 필요 -Ostwald 공정으로 질산 얻음 |



5A - P 인
인의 동소체
집합체 고체로 존재
반응성 ex.산소와..: 백린(사면체) > 흑린(결정성)
적린(무정형)

산소와 반응
+5, +3 산화물 형성

인의 산소산
인산 H3PO4
아인산 H3PO3
하이포아인산 H3PO2
| 6A ns2p4 O, S |
7A ns2p5 할로젠 원소 |
8A ns2p6 |
| -아래로 갈수록 금속성 큼, but 전형적 금속 없음 -다른 비금속과 공유결합  |
-전부 비금속 -반응성 큼 → 유리원소로 발견nono 광물, 바다에서 이온X-로 발견  |
헬륨만 2s2, 나머지는 ns2np6 완전히 채워진 원자가껍질 → 반응성 약한 불활성 기체  |
 |
  |
  |
6A - O
O2
-대기의 21%
O3 (오존)
성층권에서 자외선 흡수
프레온과 이산화질소가 오존층 파괴ㄷㄷㄷ
산소에 비해 매우 불안정

6A - S
광상과 광석
광상: PbS, HgS, FeS2
광석: 석고(CaSO4 ·2H2O), 사리염(MgSO4 ·7H2O), 석회망초(Na2SO4 ·CaSO
Frasch공정으로 황을 회수함

황 산화물

7A - 할로젠
할로젠화 수소
물에 녹으면 산으로 작용
단 HF는 약산임(해리 매우 조금..) F-가 양성자 친화력이 매우 크기 때문
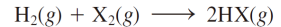


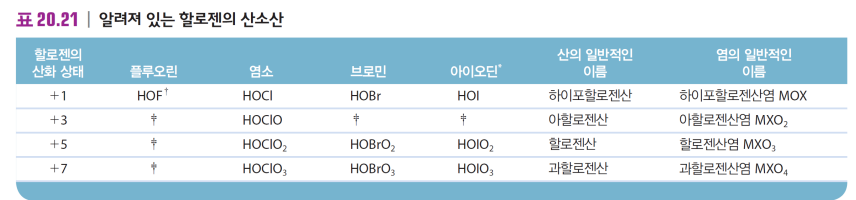
할로젠 산소산, 산소 음이온
F 제외 할로젠은 산소와 반응해 다양한 산소산 제공
산소 원자수에 비례해 산 세기가 증가함

'일반화학 > 일반화학 개념정리' 카테고리의 다른 글
| <일반 화학> 21장- 전이 금속과 배위 화학 (1) | 2023.11.28 |
|---|---|
| <일반 화학> 19장- 핵 (1) | 2023.11.27 |
| <일반 화학> 18장- 전기화학 (1) | 2023.11.18 |
| <일반 화학> 17장- 자발성, 엔트로피, 자유에너지 (0) | 2023.10.14 |
| <일반 화학> 16장- 용해도와 착이온 평형 (1) | 2023.10.13 |









댓글