배경 지식
산화 환원의 기본
환원제에서 산화제로 전자가 이동한다
표준환원전위가 작은 물질에서 높은 물질로 전자가 이동한다
- 표준환원전위: 환원반응일때 표준전극전위
- 모든 물질은 전자를 가지니 환원제도 가능, 산화제도 가능 >> 상대적인 표준환원전위가 중요함
| 산화 (환원제) | 환원 (산화제) |
| 전자 잃 수소 잃 (수소는 전자를 준다) **수소 이온 아니고 수소다!! 산소 얻 (산소는 전자를 빼앗음) 산화수 높아짐 |
전자 얻 수소 얻 **수소 이온 아니고 수소다!! 산소 잃 산화수 낮아짐 |
| 표준환원전위가 낮아야 강한 환원제 ex. 강한 환원제: 금속 - 전자를 잃고 싶어함 ex. 약한 환원제: 비금속 - 전자를 가지려 함 |
표준 환원전위가 높아야 강한 산화제 ex. 강한 산화제: 비금속 - 전자를 얻고 싶어 함 ex. 약한 산화제: 금속 - 전자를 잃고 싶어 함 |


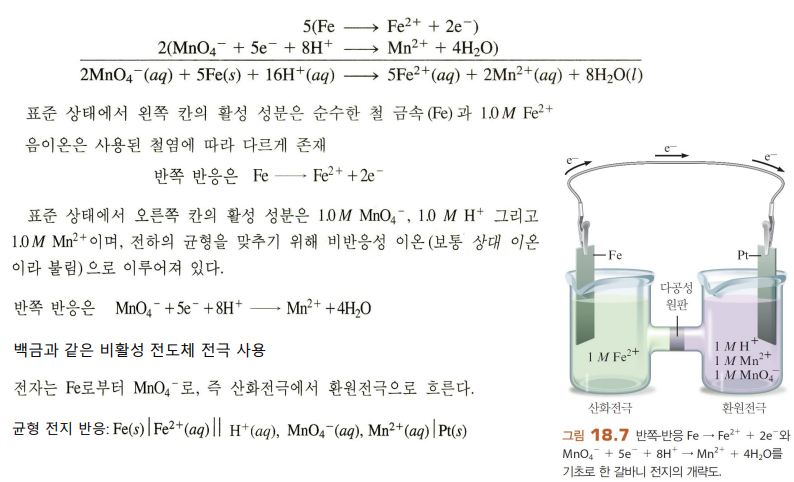
두 반쪽 반응으로 이루어짐
균형식 맞추기(복습)
다른 원소 개수 맞추기 > 산소 개수 H2O로 맞추기 > 수소 개수 H+로 맞추기 > e-로 전하 맞추기
전자 이동수 맞춰 반쪽반응 더하기
염기면 OH-로 대체
전압과 전위
전위: 전자의 위치적 에너지 (V=J/C)
전압: 전위차로 생긴 전기적 압력 → 전류를 흐르게 하는 힘
전위차가 클수록 추진력이 좋겠지!
단위 V=J/C
이동하는 전하 1C당 1J 단위의 일 (1C=6.25×1018개의 전자 전하량)
1C의 전하가 1V 전위차를 이동하려면 1J이 필요함?!?! (1C=6.25×1018개의 전자 전하량)
전압/기전력/전지전위/전위차
갈바니 전지 - 기본
화학E를 전기E(전류→유용한 일)로 얻는 장치
같은 용액에서 충돌하며 직접적으로 전자를 주고 받으면...
화학E가 열(입자 진동)으로 바뀌고 일을 얻을 수 없음
▷ ▶▷ ▶▷ 환원제/산화제 물리적으로 분리하고 전선을 통해 전자가 이동하게 함 → 전류 → 유용한 일(전기모터 등)
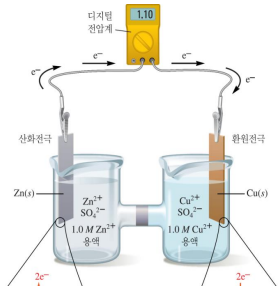
갈비니전지의 구성
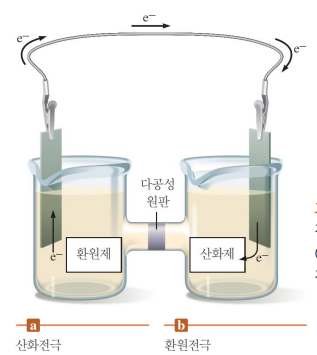

산화전극: 산화반응이 일어남 (전자잃, 양극)
환원전극: 환원반응이 일어남 (전자얻, 음극)
전선을 통해 산화전극에서 환원전극으로 전자가 이동 (전류)
염다리/다공성원반
이온이 흐르게 해 알짜 전하가 0이 되게 함
축적되는 전하로 전기가 흐르지 않는 문제를 해결 함
선표시법




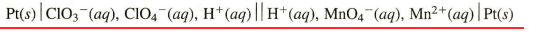
산화전극성분 (s)l(aq) ll (aq)l(s) 환원전극성분
-상차이 경계, 염다리(다공선원반)
-비반응성 이온(상대이온)들도 표시
**비반응성 이온: 전하의 균형을 맞추기 위해 존재
<반쪽 반응 보고 선표시법>
- 전지전위가 양이 되도록 산화전극/환원전극 정하기 (E°(cell) = E°(red)환원전극 - E°(red)산화전극)
- 전도체 없는 전극은 비활성 전도체 필요
- 비반응성 이온 주의
전지전위=기전력 E°(cell)
전지전위=기전력 E°(cell) (전압=전위차)
전자를 끌어내는 힘(추진력) from 전위차
단위: V=J/C (이동하는 전하 1C당 일) (C
전압계를 이용해 측정
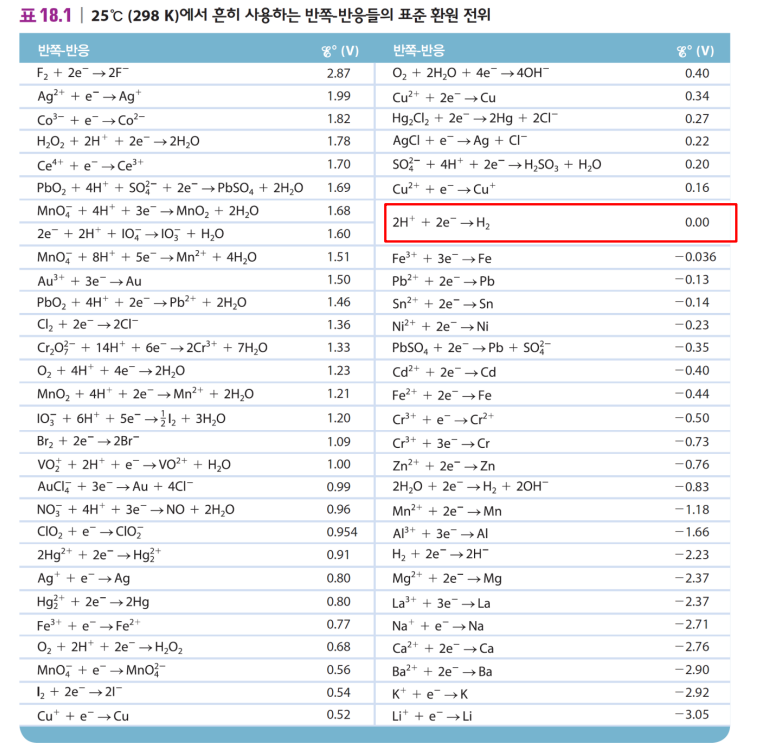
표준환원전위 E°(red)
표준 환원 전위 E°(red)
표준 수소 전극와 결합해 반쪽 전지가 환원될 때 전지에서 측정한 전위
(or 산화되면 그 전지전위의 음의 값)
1M의 용액, 1atm 기체에서 환원 반쪽반응의 E°값
단위: V=J/C
<부호의 이해>
표준환원전위>0 면 수소보다 환원 잘 됨
표준환원전위<0 면 수소보다 산화 잘 됨 (환원 잘 안 됨)
!!!헷갈리지 말 것!!!
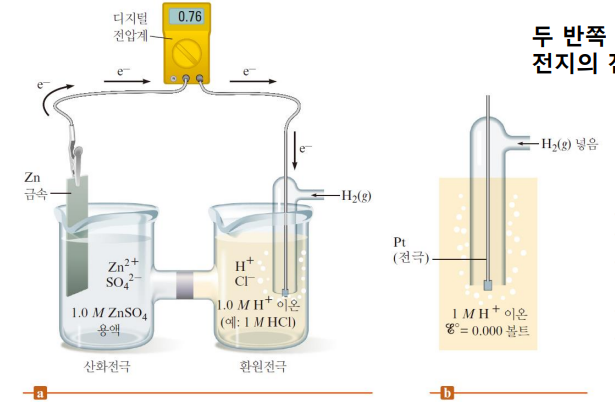
ex. 아연은 표준수소전극이랑 연결했더니 산화되고, 전지 전위 E°(cell)는 0.76V로 측정 됨
그럼 표준산화전위 E°(oxi) 가 0.76V이고, 표준 환원전위 E°(red)는 -0.76V임
표준산화전위와는 부호만 반대임
전지를 반쪽으로만 만들 수 없자나.. 그래서 수소랑 짝지어서 전위값을 구해주는 거야
전지 전위에서 표준수소전극을 0V라고 퉁치고 반쪽반응의 전위값으로 자정해준다
표준 수소 전극을 0V로 기준 삼는 셈!
**표준 수소 전극: 1M H+용액, 1atm 수소기체, 백금 도체

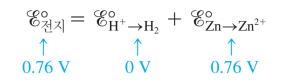
즉 Zn의 표준산화전위는 0.76, Zn2+의 표준환원전위는 -0.76
그 후 다른 애들끼리 짝지을 땐 두반쪽반응 전위값의 합으로 생각한다

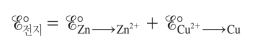

<환원제&산화제의 표준환원전위로 전지전위 구하기>

E°(cell) = E°(red)환원전극 - E°(red)산화전극
단위: V=J/C
-둘 중 표준환원전위가 더 큰 게 환원전극 ( E°(cell)이 양수가 나오도록 )
-산화 반쪽 반응은 표준환원전위의 부호를 반대로
-표준환원전위는 '세기 성질'이기에 반응식 계수와 무관함
전지 전위 & 열역학 (전기적 일, 자유E, 농도 의존도)
전지 전위와 전기적 일
기전력(전압)=전위차로 인한 추진력
▶전지 전위에서 전하 이동당 얻어지는 일을 결정함
▶기전력이 양수여야 자발적, 일을 얻을 수 있음
▶기전력이 커야 많은 일을 얻을 수 있음
기전력=전위차(V)=일/전하(J/C)
***계 기준: 일을 하면 계에서 일이 빠져나오니 음수 E=-w/q
V=J/C의 이해
1C 전하가 이동할 때 발생하는 nJ의 일=nV
nJ은 1C 전하가 nV 전위차가 있는 두 점 사이 이동할 때 생성or소비되는 일
솔직히 잘 이해 안되네오...ㅋ 무조건 1V 이동하면 1J인거야??
<전지전위로 전기적 일 구하기>
V=J/C에 의해.. 전지전위=-일/전하
E=-w/q
-w=qE=nFE
△G=w=-nFE △G는 그 과정으로부터 얻어낼 수 있는 최대한의 유용한 일
**n은 mol
**F는 페러데이 상수 96485 C/mol e-
전지 전위와 농도 의존도
<르샤틀리에의 법칙>
표준상태(전부 1M)인데..
-반응물 늘어남 or 생성물 줄어듦 -> 전지전위 증가
-반응물 줄어듦 or 생성물 늘어남 -> 전지전위 감소
추진력이 세지냐.. 약해지냐...
그 외 △G = △G°-RTlnQ = -nFE 를 응용해
전지전위-농도 관계식인 <네른스트식>도 있지만 나는 안 배운다 하하하하하 아 개꿀^ㅁ^
<농도차 전지>
동일한 화합물이지만 농도만 다르게 만든 갈바니 전지
이온 농도가 자발적으로 같아지려는 것이 추진력 농도가 같으면 E°(cell)=0
그래서 별로 전압이 세진 않은...ㅋ

생활에 적용 - 배터리, 부식
배터리
단일or그룹 갈바니 전지. 전위는 전지 전위들의 합
역반응 일어나게 전류 흘려주면 충전 됨
납 축전지
납-산화전극, 이산화납-환원전극 in 황산용액
점점 황산이 소비되고.. (순수 전자냠냠ㄴㄴ) 황산용액 밀도로 배터리 상태 알 수 있음
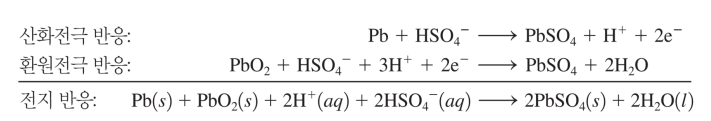
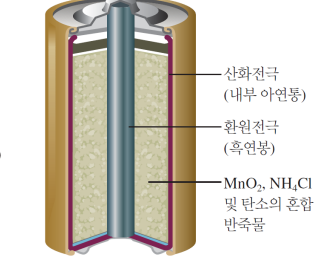
건전지
산화전극(내부아연통)-MnO2 NH4Cl/KOH/NaOH 등의 반죽물-환원전극(흑연탄소봉)
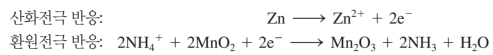
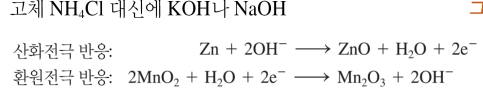
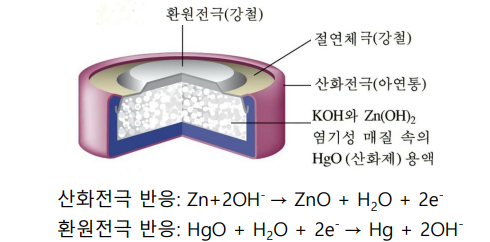
수은 건전지
산화전극(아연통)---환원전극(강철)...
니켈-카드뮴 전지
산화전극(카드뮴)-환원전극(니켈)
재충전 가능

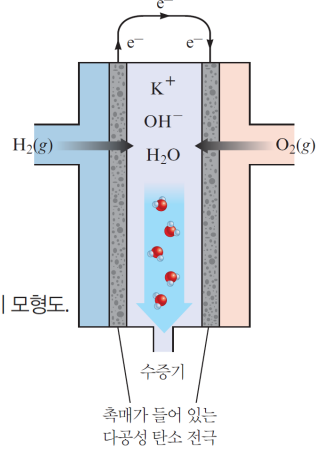
연료전지
반응물을 계속 공급해야..
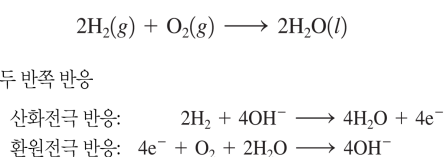
부식
금속이 뽑아내기 전 광석으로 돌아가는.. 산화과정
표준환원전위가 산소의 표준환원전위보다 작음. 그래서 산화반쪽반응으로 결합될 수 있음
알짜적으로 양수가 되니께
보호산화막
대부분 금속은 얇은 산화막을 형성해 내부가 산화되지 않게 함 ex.Al2O3
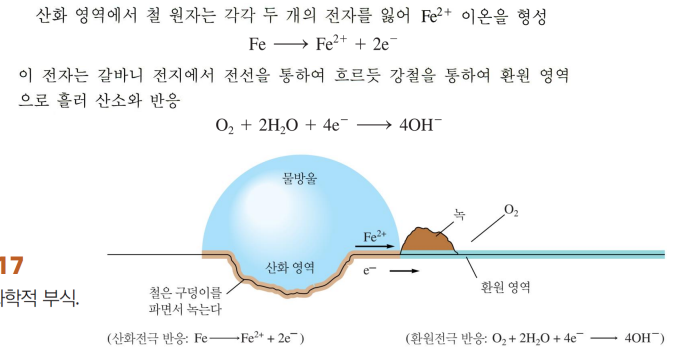
철
철은 보호산화막으로 커버가 안 됨.
불균일하게 산화영역(산화 잘 되는 곳), 환원영역(ㄱㅊ한 곳)이 생기기 때문
-강철의 화학조성은 불균일함
-물리적 변형으로 취약점이 생김

철의 부식 방지
| 아연 도금 | 음극 보호 |
| 철보다 활성이 큰 금속이라 희생막이 됨 | 더 좋은 환원제인(활성이 큰) 금속을 연결 함 ex. 마그네슘 |


'일반화학 > 일반화학 개념정리' 카테고리의 다른 글
| <일반 화학> 19장- 핵 (1) | 2023.11.27 |
|---|---|
| <일반 화학> 20장- 주족 원소 (4) | 2023.11.21 |
| <일반 화학> 17장- 자발성, 엔트로피, 자유에너지 (0) | 2023.10.14 |
| <일반 화학> 16장- 용해도와 착이온 평형 (1) | 2023.10.13 |
| <일반 화학> 15장- 산염기 평형 (0) | 2023.09.24 |


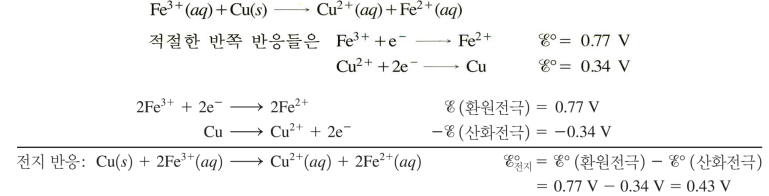











댓글