영상 강의
라디칼의 특성
라디칼(Radical)이란? 홀전자를 가진 분자
주로 homolytic cleavage하면 생김
탄소 라디칼 구조의 특징

탄소 양이온 ~ 탄소 음이온의 중간과도 같은 구조이다
탄소 양이온의 trigonal planar처럼 이해하거나
탄소 음이온의 trigonal pyramidal인데 빠르게 뒤집히는 상태라고 보면 된다.
둘 중 어느 쪽이든 racemic한 성질을 가진다
라디칼의 안정성
탄소 양이온의 안정성과 동일하게 생각하면 된다
benzyl allyl 3차 2차 1차 methyl aryl vinyl ..
라디칼 반응의 기본개념
-라디칼 반응의 6 패턴, 공명-
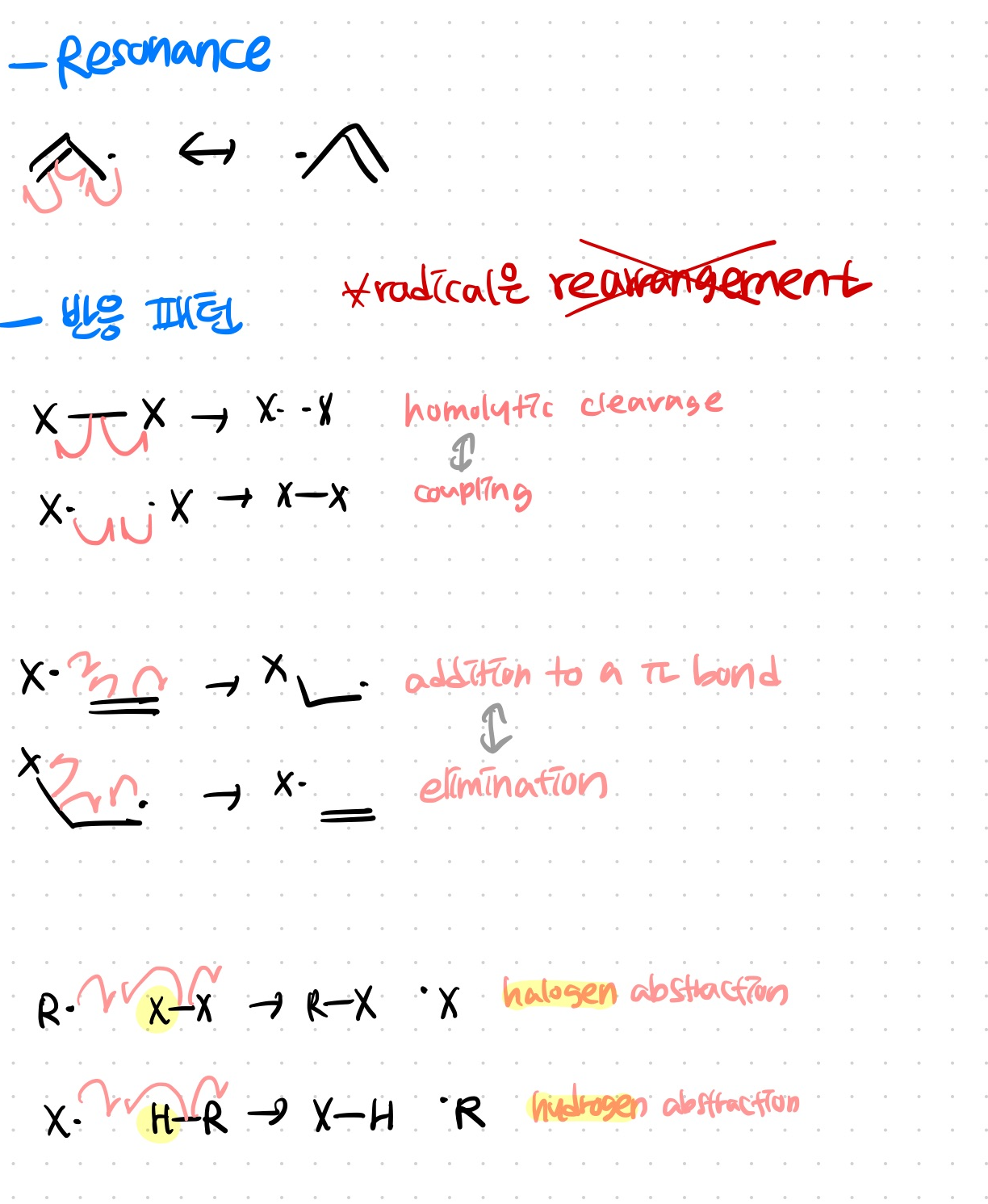
homolytic cleavage - coupling
addition to a pi bond - elimination
이렇게는 역반응 같은 관계로 이해하면 된다
halogen abstraction, hydrogen abstraction은 둘 다 다른 것에서 빼앗는 듯한(?!) 반응이다
참고로 라디칼도 resonance를 한다
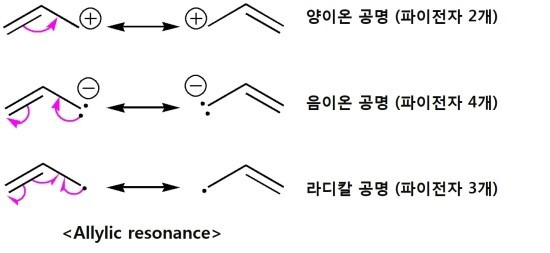
그러나 rearrangement는 하지 않는다
-라디칼 반응의 initiation, propagation, termination-

라디칼 반응은 3단계로 구성된다
- initiation: 라디칼을 만들어 라디칼 반응이 일어나게 한다
- propagation: 알짜반응을 이룬다
- termination: 라디칼을 없애 라디칼 반응이 종결되게 한다
라디칼 initiator, inhibitor
-radical initiator-
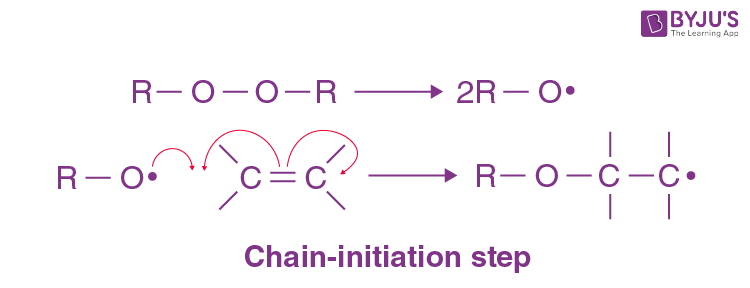
peroxide처럼, homolytic cleavage를 해서 radical이 된다
그럼 그 radical이 다른 radical을 만들고.. 걔가 다른 radical을 만들고..
연쇄적으로 radical 반응이 촉진된다
-radical inhibitor-
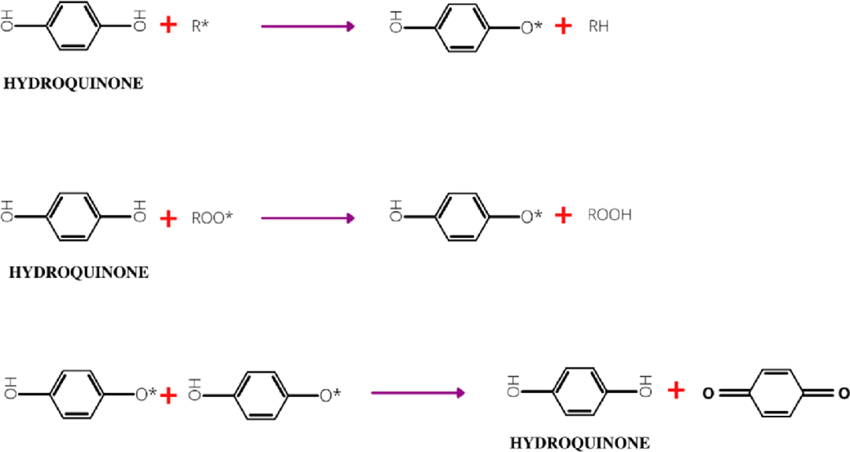
반대로 radical inhibitor는 radical을 없애 라디칼반응을 종결한다.
hydroquinone은 대표적인 radical inhibitor이다!
자신 H 2개를 각각 2개의 radical과 반응시켜 종결할 수 있고,
공명을 통해 안정된 구조가 된다
라디칼 반응
Radical Halogenation (Alkane)
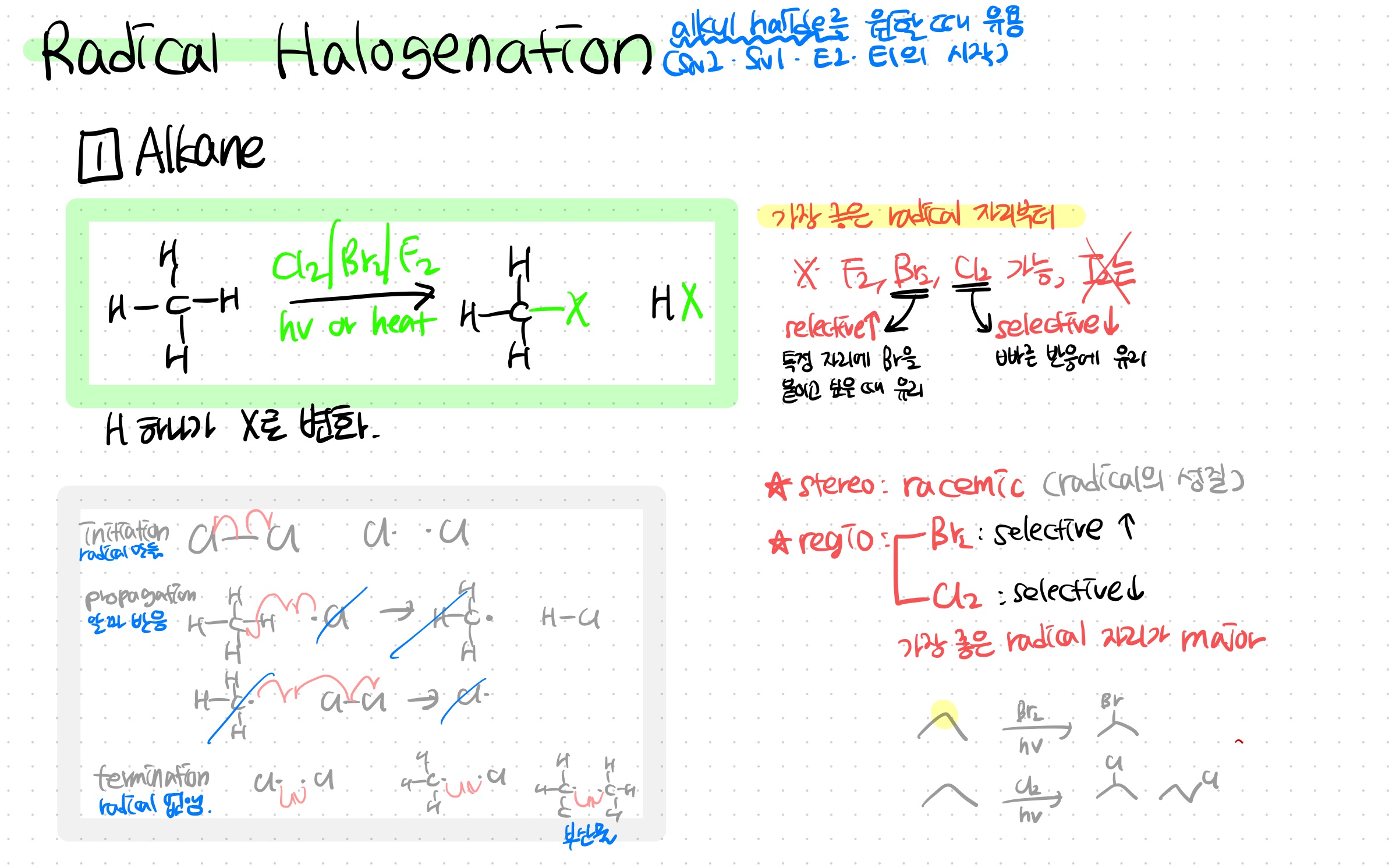
★alkane으로부터 alkyl halide를 만들고 싶을 때 유용하다★
Alkane과 Cl2, Br2 등 X2를 heat 혹은 hv와 함께 반응시키면,
가장 라디칼이 될 때 안정한 자리인 H가 X로 바뀐다
**이 때,
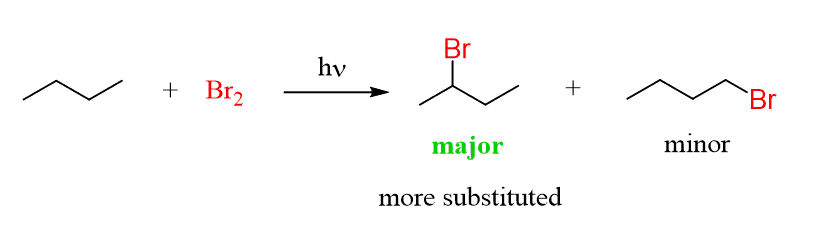
* Br2는 가장 안정한 자리가 X로 바뀌도록 selective한 반응을 한다. 대신 느리다
* Cl2는 selectivity는 떨어지되 빠른 반응을 한다
>>따라서 어떤 자리인가가 중요할 땐 Br2, 빠른 반응을 원할 땐 Cl2를 이용하면 좋다
I2는 열역학적으로 라디칼 halogenation 반응이 일어나기 힘들어 안 일어남
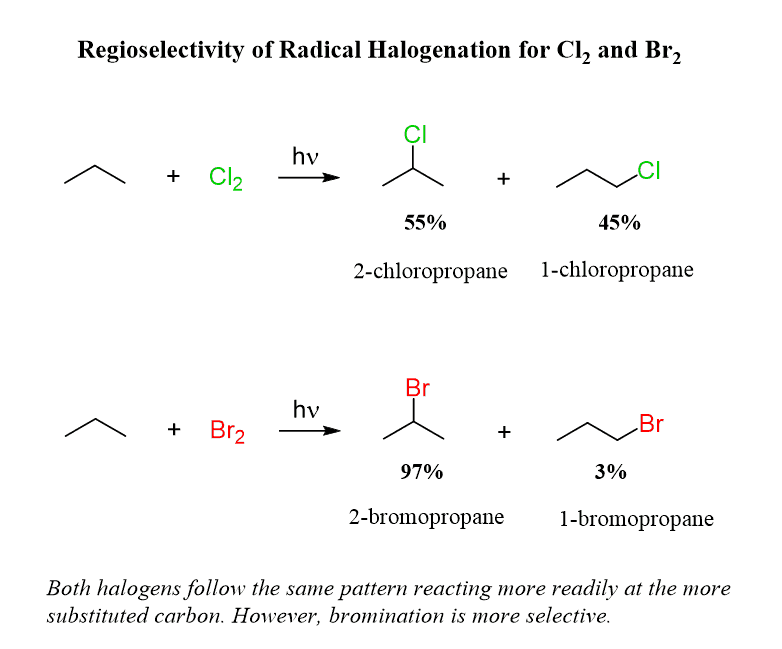
여길 보면 2차 자리가 제일 라디칼이 안정해서, Br은 거기 위주로 생기지만 Cl은 1차도 많이 생김
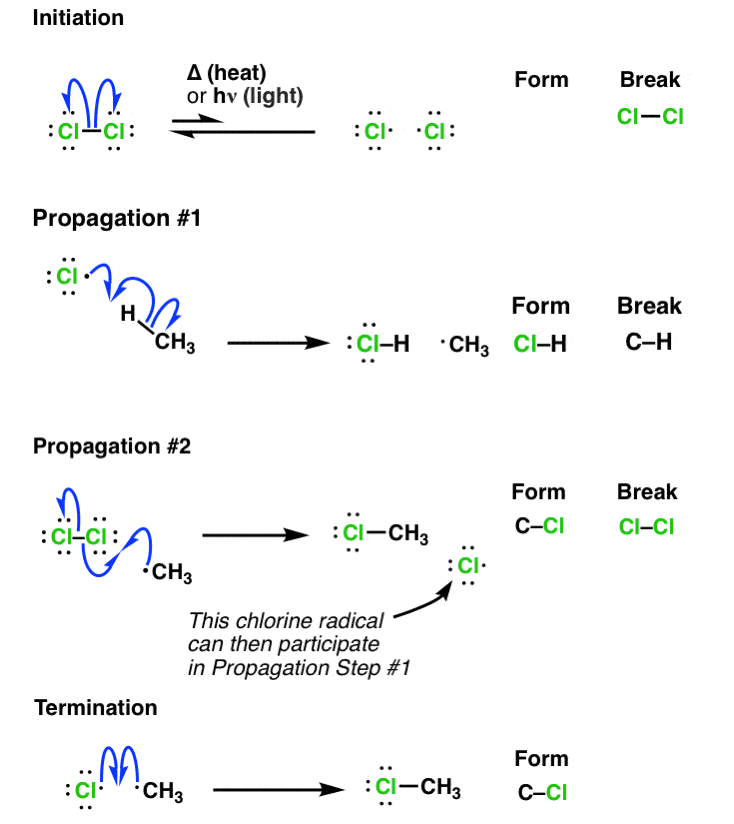
메커니즘은
-initiation: hv, heat에 의해 X2가 라디칼이 되고
-propagation: X 라디칼이 alkane을 라디칼로 만들고, 라디칼 alkane이 X2로부터 X를 받고 X라디칼을 만들고.. 그 X라디칼이 alkane을... (반복)
-termination: 라디칼끼리 반응해 라디칼이 사라져 반응이 종결된다 **이때 원치 않는 부산물(ex.C2H6)이 나올 수 있음 주의
Radical Halogenation (Alkene)
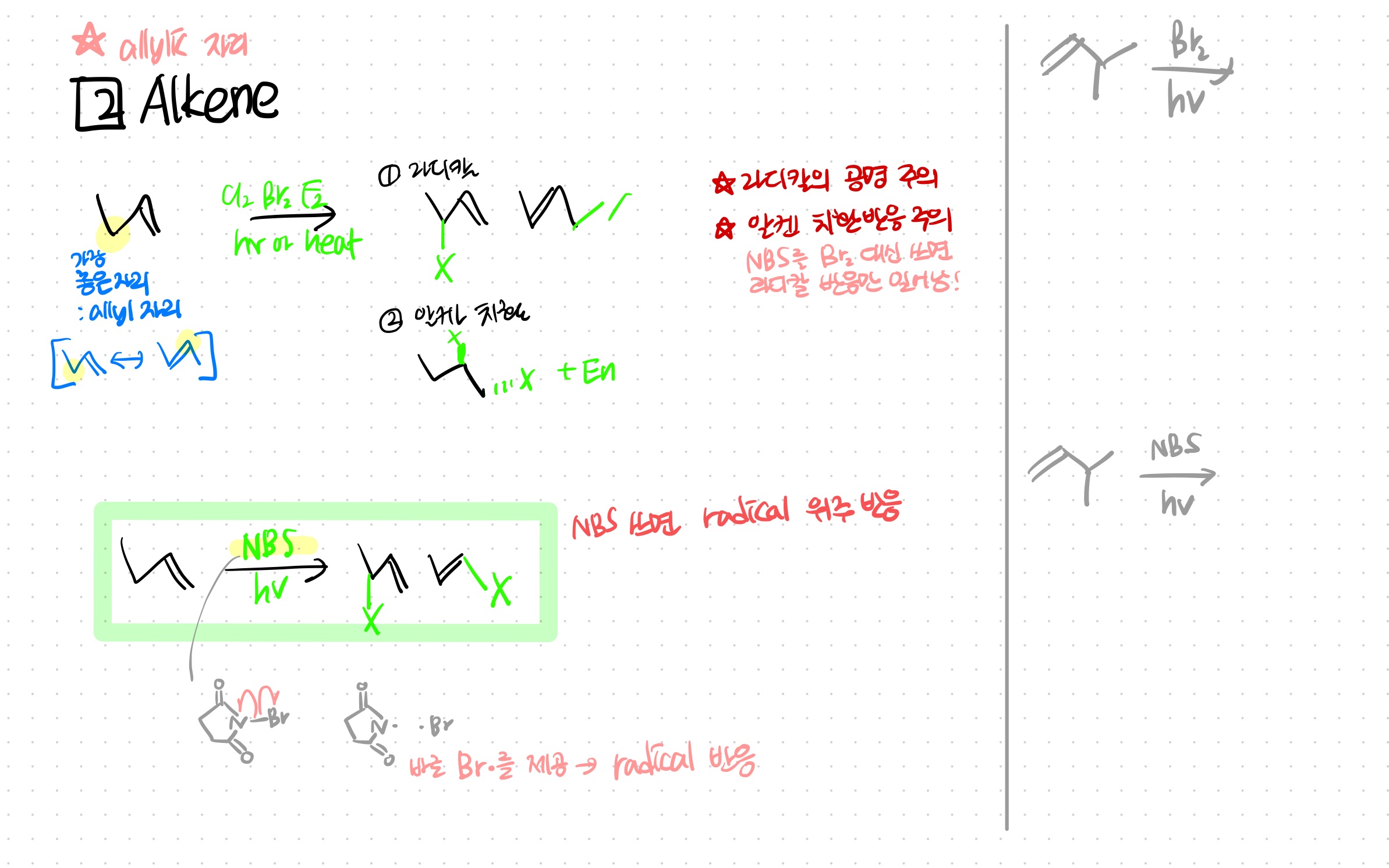
alkene이 radical halogenation을 하면 allylic 자리가 가장 안정해서 거기로 X가 붙는다.
allyl 자리가 라디칼이 된 후 공명해서, 공명한 애에서 반응을 한 구조이성질체도 생성물도 나올 수 있음에 주의하자
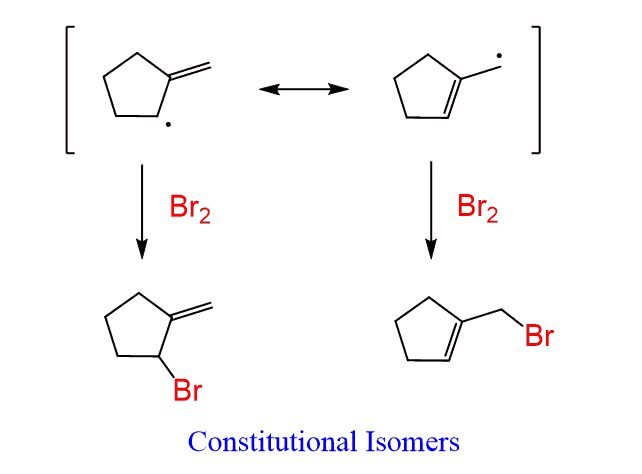
또 주의할 것은..
alkene에 X2를 반응하는 건 alkene의 X X 첨가반응과 겹칠 수 있음
그래서 생성물로 dihalide alkane이 나올 수도 있다!!
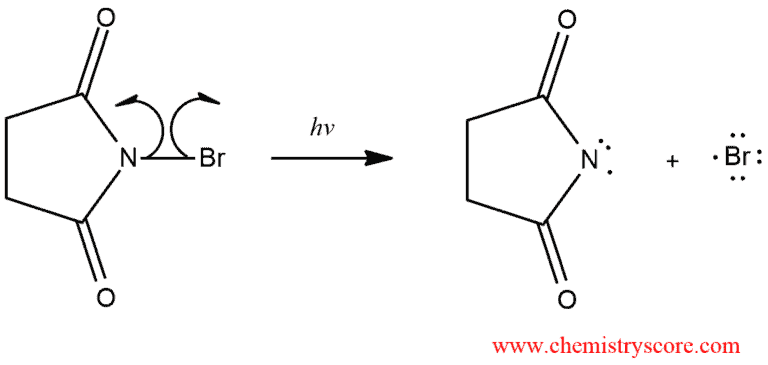
그래서 NBS radical bromination을 이용하면 좋다
NBS는 Br2보다 Br 라디칼을 잘 만들기 때문에,
Br2보다 NBS를 쓸 때 라디칼 반응으로 유도하기 좋다
Autooxidation
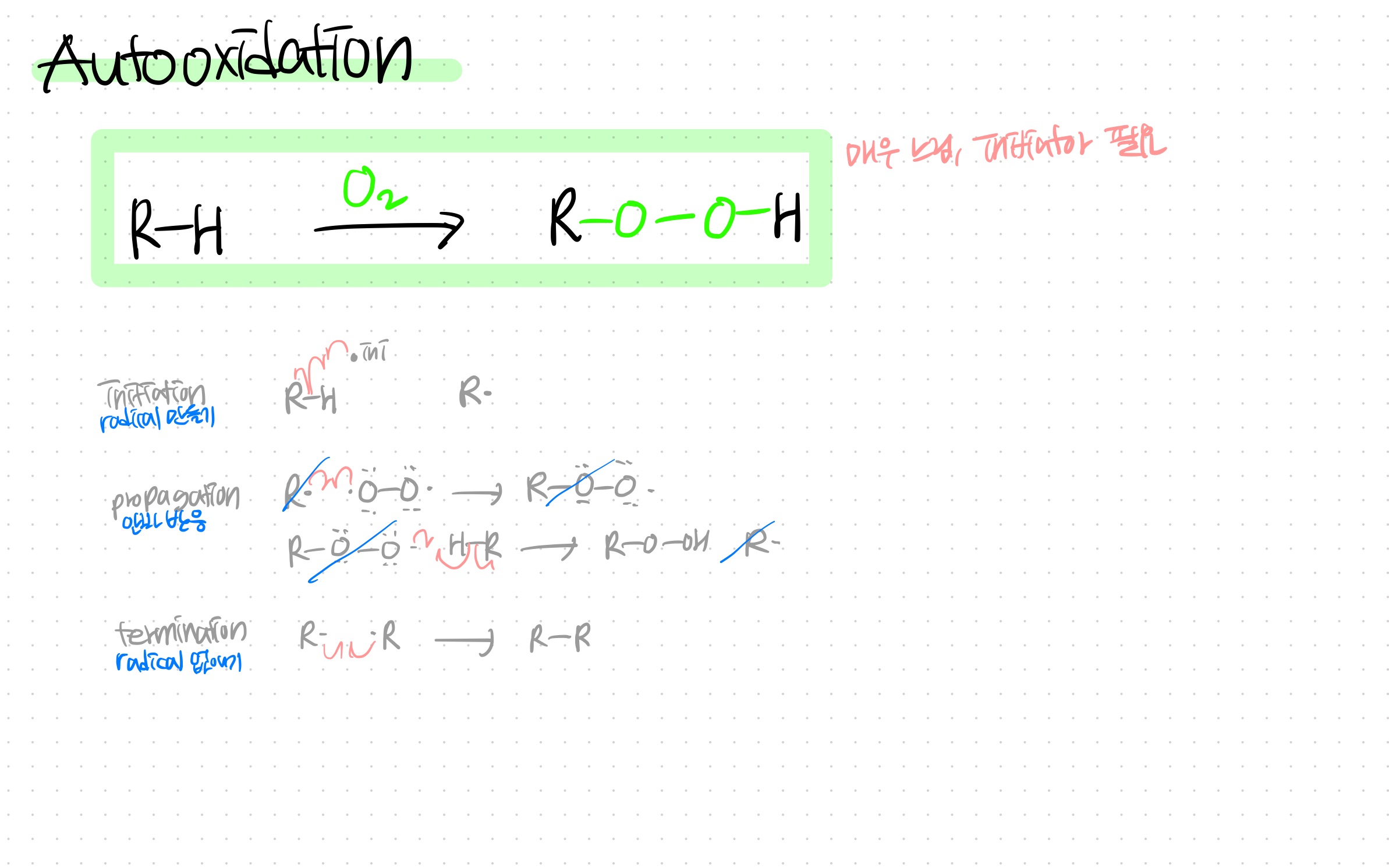
O2랑 반응해 ROOH가 되는 것도 라디칼 반응이다
자세한 건 그림 속 메커니즘을 참고...
HBr Anti-Markovnikov 첨가반응
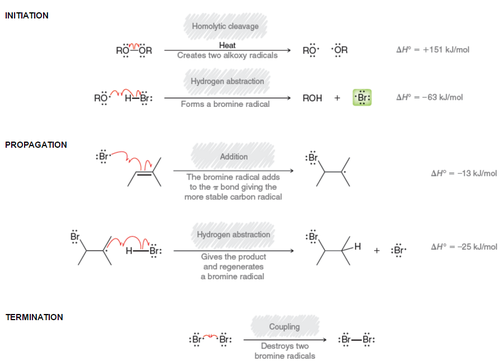
이전 alkene, alkyne 첨가반응에서도 봤던 HBr ROOR 반응이다.
ROOR의 OR이 radical initiator로 작용해 Br 라디칼을 만들고,
Br 라디칼이 먼저 alkene과 반응하기 때문에,
라디칼은 안정한 자리에 만들기 위해서 덜 치환된 자리에 Br이 붙게 된다
그리고 alkene에 생긴 라디칼이 HBr의 H를 빼앗고 다시 Br 라디칼을 만드는..
Radical Polymerization

alkene이나 치환된 alkene을 radical initiator와 반응시켜 중합반응이 연쇄적으로 일어남
'유기화학' 카테고리의 다른 글
| 유기화학 강의 12. 콘쥬게이션 화합물 (0) | 2025.01.05 |
|---|---|
| 유기화학 강의 11. 합성 연습 문제 (0) | 2025.01.04 |
| [유기 화학] 8. Alkyne 첨가 반응 (0) | 2024.07.29 |
| [유기 화학] 7. Alkene 첨가 반응 (0) | 2024.07.25 |
| [유기 화학] 6. Alkyl halide의 치환/제거 반응: SN2 SN1 E2 E1 (7) | 2024.07.24 |


댓글