영상강의
Alkyl Halide
명명법
fluoro- chloro- bromo- iodo- 작용기 취급
탄소 치환기와 같은 우선순위임. 그냥 알파벳 순으로 순서 매겨주면 됨
특징
1. induction
전자를 끌어당겨, 친핵성 공격을 잘 받게 한다
2. 좋은 leaving group
X-는 octet으로 인해 안정함. 좋은 이탈기임
>> 치환, 제거 반응에 유리함!
치환 vs 제거반응
| 치환 반응 | 제거 반응 |
| 친핵체와 반응 | 염기와 반응 |
| X- 대신 친핵체 붙음 | 염기가 양성자를 빼앗아 이중결합 생성, X- 제거됨 |
| SN2, SN1 | E2, E1 |

| SN2 | SN1 | E2 | E1 | |
 |
 |
 |
 |
|
| 메커니즘 | 친핵체공격+이탈기이탈 동시에 일어남 | 이탈기이탈 후 친핵체공격 *탄소양이온 거침 |
염기공격+이탈기이탈 동시에 일어남 | 이탈기이탈 후 염기공격 *탄소양이온 거침 |
| 반응속도 | 2차 반응 (동시에 일어남) v=k[substrate][reagent] |
1차 반응 (이탈기 이탈 먼저) v=k[substrate] |
2차 반응 (동시에 일어남) v=k[substrate][reagent] |
1차 반응 (이탈기 이탈 먼저) v=k[substrate] |
| 기질 | alpha: methyl>1>2>3 backside attack 하려면 steric하지 않아야 함 |
allyl, benzyl>3>2>1 탄소양이온이 안정할수록 좋음 |
steric해도 됨 (양성자 공격해서 방해x) 오히려 3>2>1 선호 전이상태가 안정함 |
allyl, benzyl >3>2>1 탄소양이온이 안정할수록 좋음 |
| nucleophile base |
강한 친핵체 |
약한 친핵체 **단, 3차 기질이면 강한 친핵체여도 SN1 |
강한 염기 |
약한 염기 |
| solvent | protic solvent 친핵체를 불안정하게 만들어 반응을 촉진 |
protic solvent 탄소양이온 & X-를 안정화해 반응을 촉진 |
||
| 구조 | inversion (backside attack 때문) |
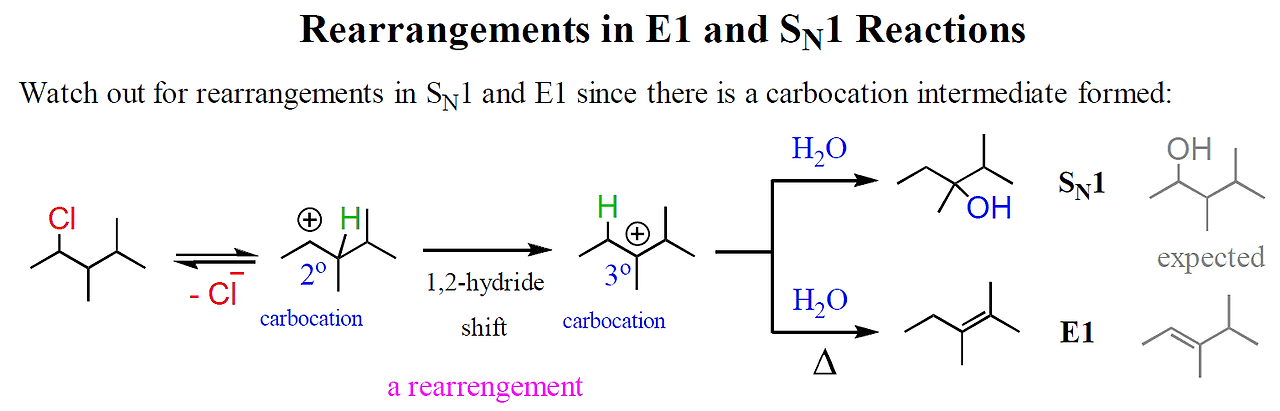
racemic **rearrangement 주의 (C+ 때문) |
<regioselective> 작은 염기: Zaitsev steric 염기: Hofmann <stereoselective> 수소가 2개일 경우 2가지 구조 가능 (둘 중 더 안정한게 major) <stereospecific> 수소가 1개일 경우 1가지만 가능 (anti-periplanar 때문) |
<regioselective> 언제나 Zaitsev major 언제나 stereoselective **rearrangement 주의 (C+ 때문) |

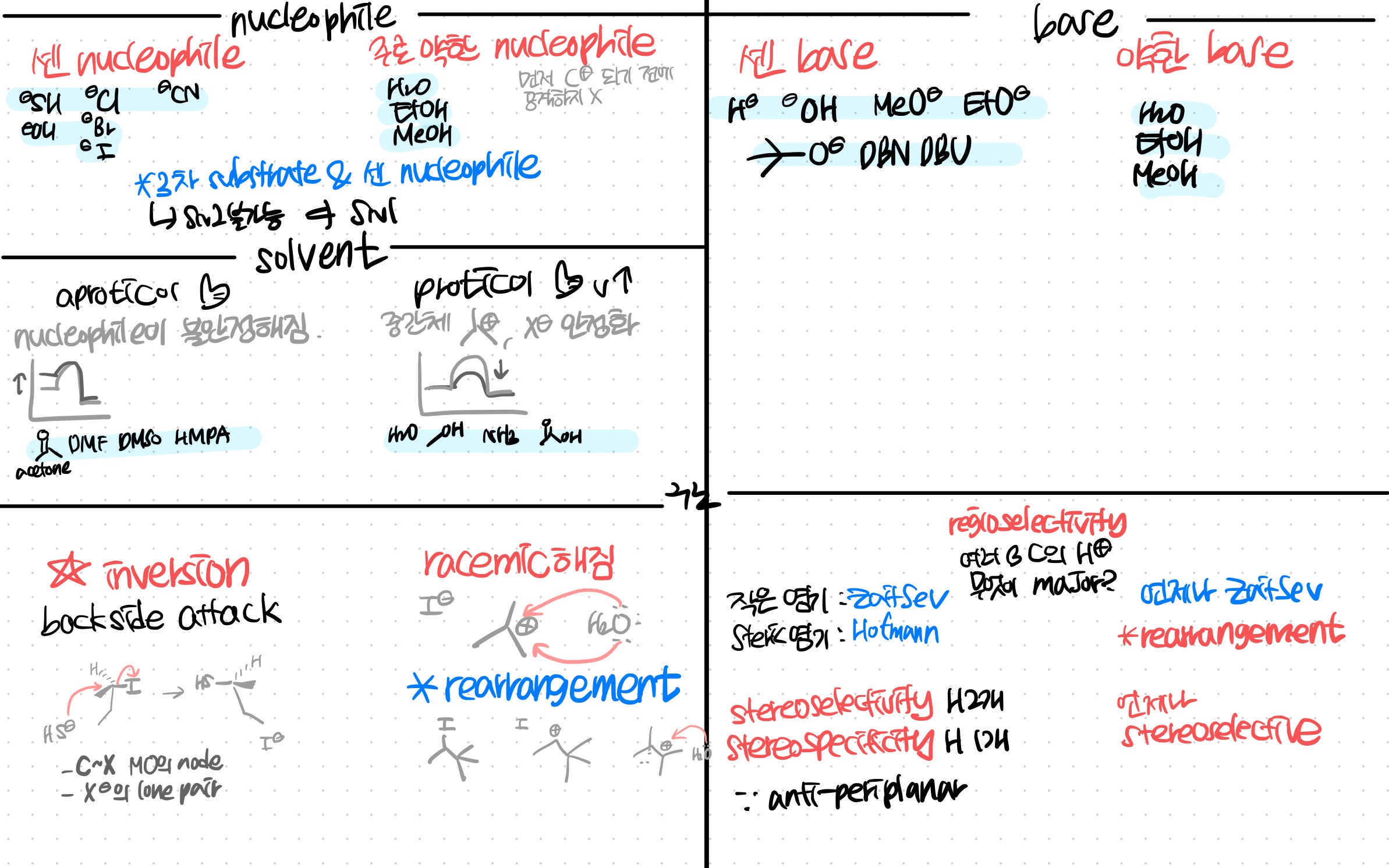
SN2
0. 메커니즘과 반응속도

친핵체가 할로젠 뒤쪽을 공격하면, 동시에 할로젠이 이탈한다.
따라서 반응속도는 v=k[substrate][reagent]
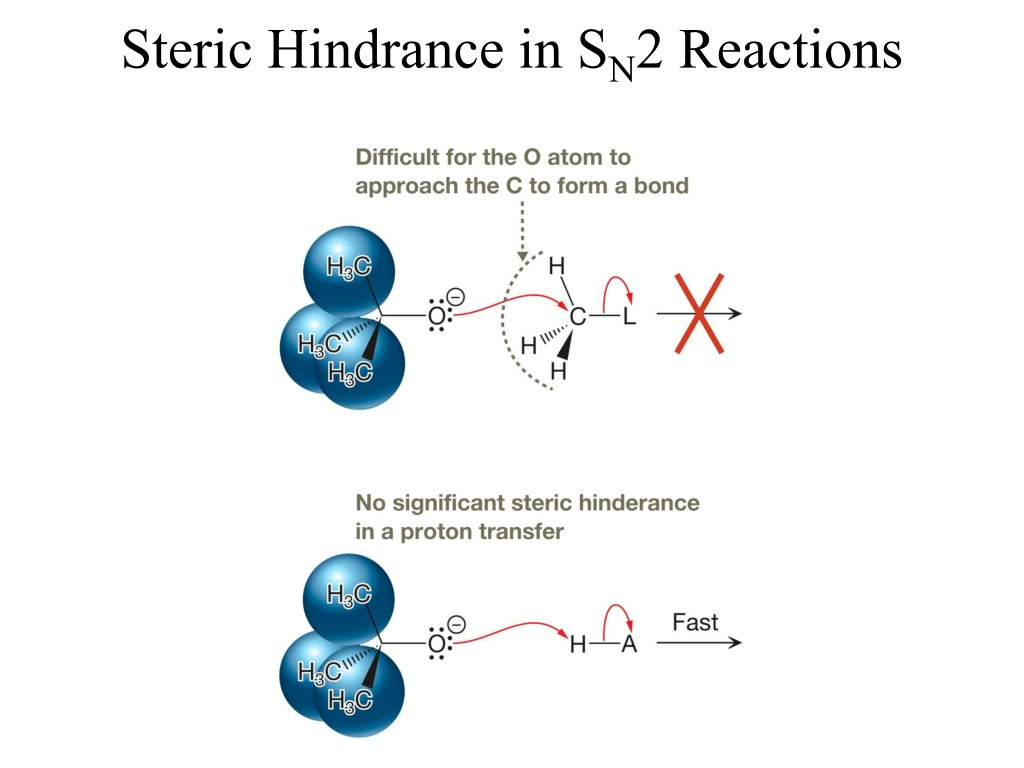
**backside attack
친핵체가 X의 뒤쪽으로 접근하지, 앞으로 접근하지 않는다.
앞에는 분자오비탈의 node, X의 전자쌍으로 인해 접근이 어렵다
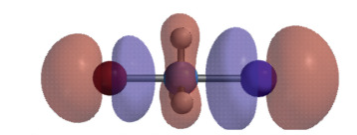
1. substrate
기질(alkyl halide)의 알파 탄소가 methyl > 1차 > 2차 > 3차 일수록 SN2가 잘 일어남
알파 3차, 베타 3차는 SN2가 일어나지 않는다.
steric해서 방해되면, backside attack을 하기 힘들기 때문이다.
전이상태 역시 불안정해지고 말이다.
+ 물론 이탈기가 좋은 이탈기일수록 속도가 빨라짐
2. nucleophile
친핵성 공격을 잘할수록 SN2가 잘 일어나기 때문에,
강한 친핵체여야 SN2가 잘 일어난다.
SH- RS- OH- RO- Cl- Br- I- CN- 등...
단, 아무리 강한 친핵체여도 기질이 알파3차, 베타3차면 SN2가 일어날 수 없다
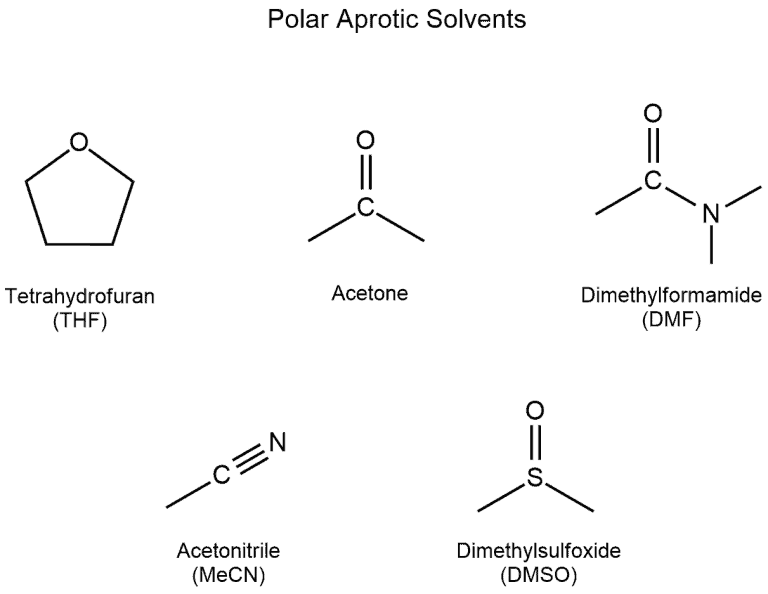
3. solvent
polar aprotic한 solvent가 좋다.
nucleophile을 불안정하게 만들어(반응물을 불안정하게 만들어) 반응을 촉진한다
DMF, DMSO, THF, acetone, acetonirile 등이 있다.
4. 구조의 변화
backside attack을 하기 때문에 구조의 inversion이 나타난다.

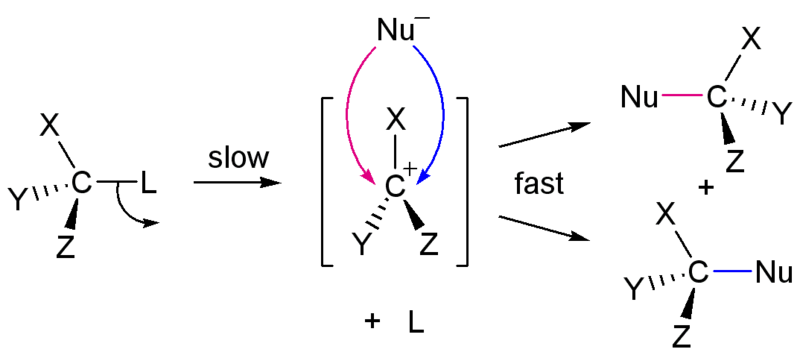
SN1
0. 메커니즘과 반응속도

순차적으로 일어난다.
먼저 이탈기가 이탈한 후, 친핵체가 붙는다.
따라서 반응속도는 v=k[substrate]
친핵체가 많아봤자.. 이탈기가 이탈하지 않으면 반응하지 못하기 때문이다.
1. substrate
allyl benzyl > 3차 > 2차 > 1차 일수록 유리히다.
탄소양이온이 되기 좋기 때문이다.
그냥 1차는 SN1 못 일어남 (allyl, benzy 1차는 가능)
2. nucleophile
약한 친핵체여야 좋다.
이탈기가 떨어져 탄소양이온이 되기 전에, 친핵체가 먼저 공격해버리면 SN2가 되기 때문이다.
H2O, EtOH, MeOH 등...
>> 보면 E1에서의 약한 염기와 같다.
친핵체로 작용하면 SN1, 염기로 작용하면 E1이 된다.
따라서 E1, SN1은 보통 동시에 일어난다.
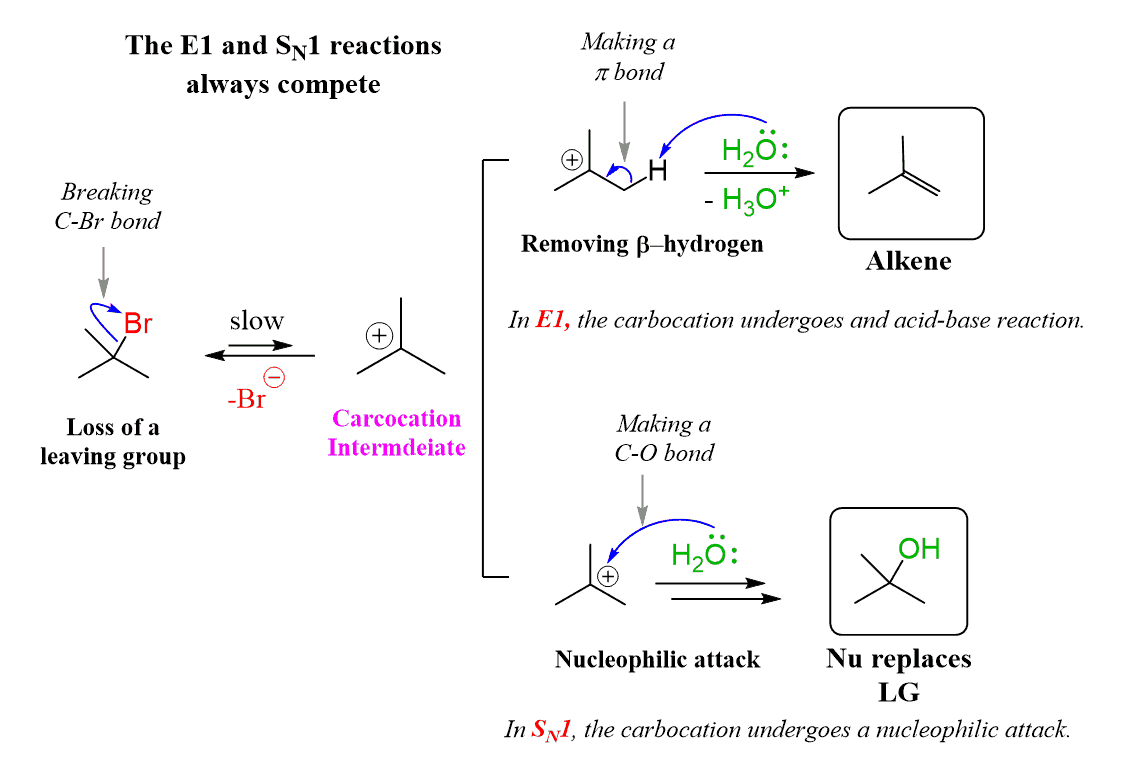
단, 3차 substrate + 강한친핵체 조합도 SN1이다.
3차의 steric함 때문에 backside attack이 못 일어나, 어쩔 수 없이 이탈기가 먼저 떨어지길 기다려야 하는 셈이다.
3. solvent
polar protic solvent가 SN1 반응에 유리하다
중간체인 탄소양이온, X-를 안정화하기 때문이다
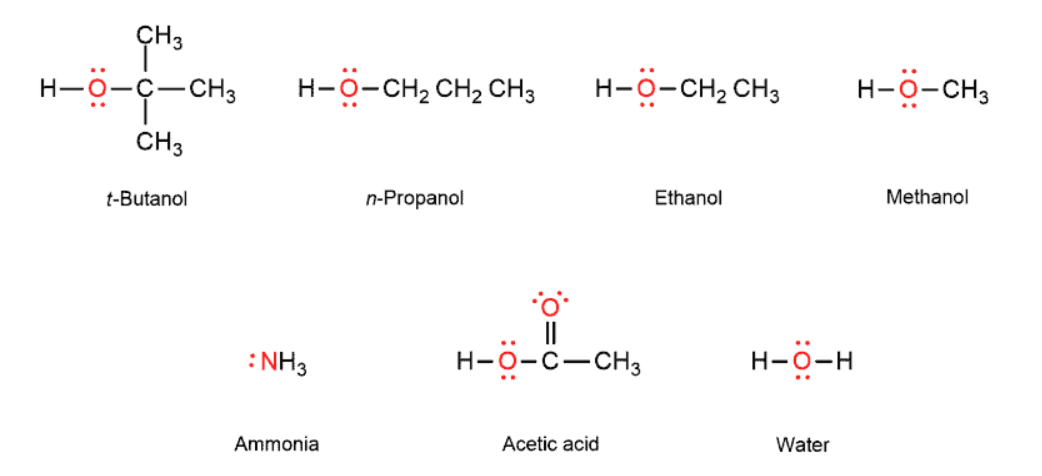
4. 구조의 변화
racemic해진다.
탄소양이온을 거치기 때문에, 양쪽 면에 친핵체가 접근할 수 있다.
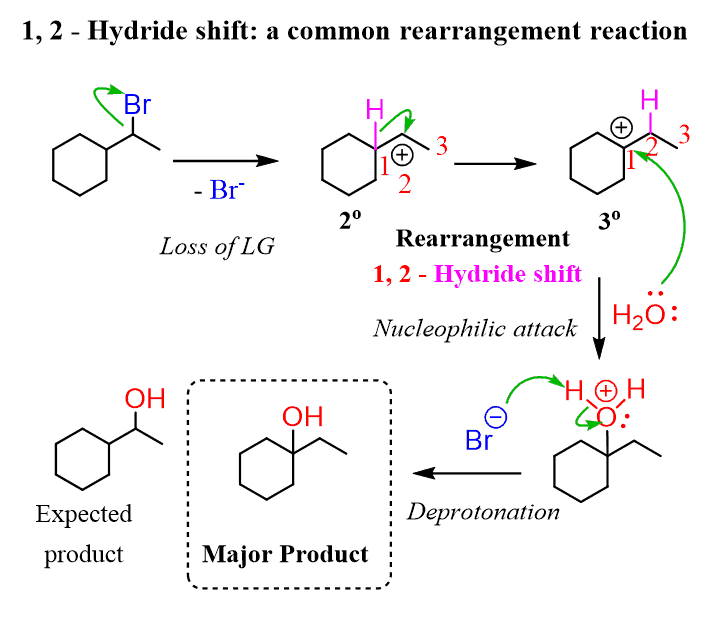
rearrangement를 거칠 수도 있다.
탄소양이온을 거치기 때문
*rerrangement 되는 상황은 지난 글을 참고 - benzyl allyl 3차 2차 1차 될 때 / 작은 고리가 큰 고리 될 때
E2
0. 메커니즘과 반응속도

베타 탄소 자리의 양성자를 염기가 공격하고,
2중결합을 이룸과 동시에 할로젠이온 이탈기가 이탈 됨
따라서 반응속도는 v=k[substrate][reagent]
1. substrate
SN2와 달리 steric한 substrate여도 된다.
H는 steric해도 접근이 쉽다
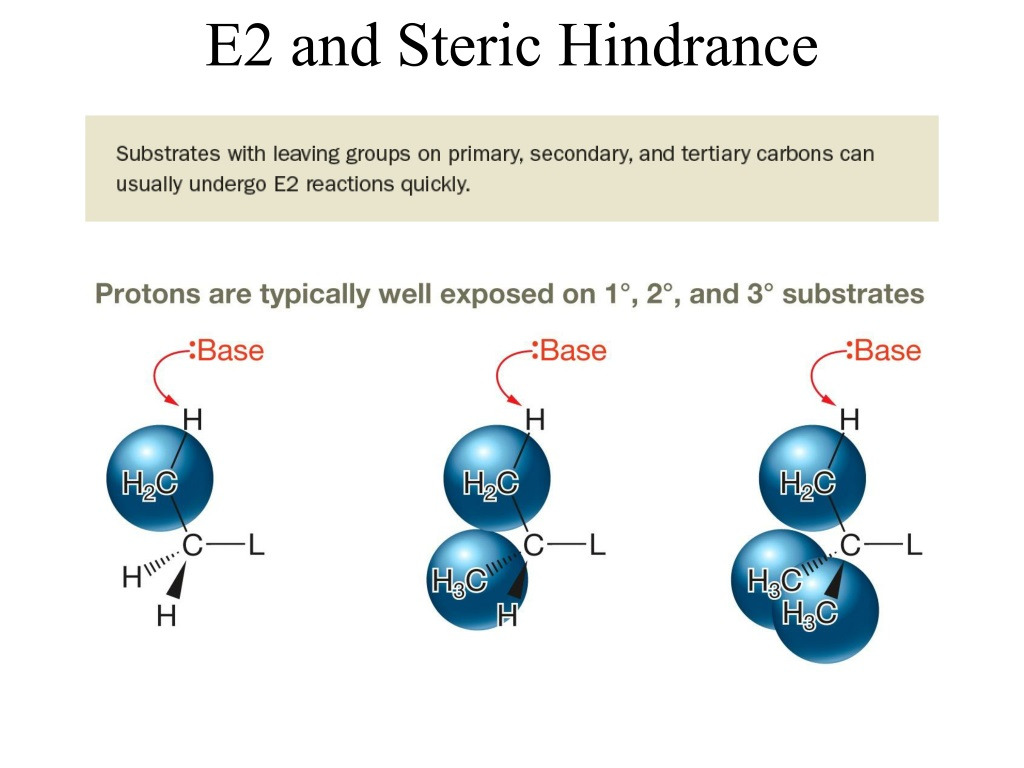
되려 3차 > 2차 > 1차를 선호한다.
중간체가 안정해지기 때문이다
2. base
강한 염기여야 한다
OH-, EtO-, MeO-
H-
But-O-, DBN, DBU, disiamylborane (강한 steric base)
4. 구조의 변화
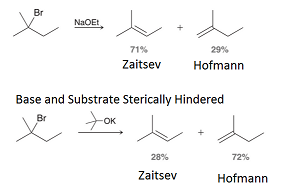
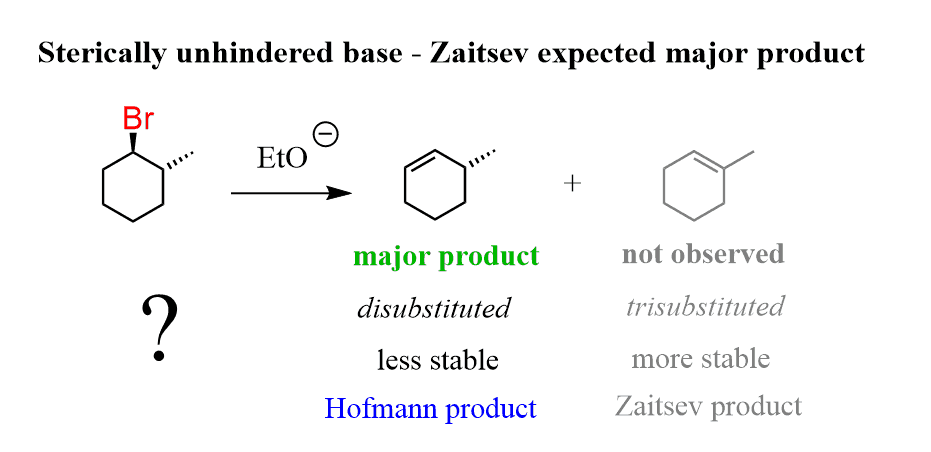
★regioselective
여러 서로 다른 베타탄소 자리가 있을 수 있다.
이때 모두 반응이 가능하지만, 가장 많은 반응물을 만드는 major 베타탄소 자리가 있을 것이다
반응 결과 substituted가 많이 되는 것이 Zaitsev, 적게 되는 것이 Hofmann이다.
-작은 염기(H-, OH- 등): Zaitsev major
-큰 염기(DBN DBU but-O- 등): Hofmann major
★stereoselective
그 베타탄소 자리에 수소가 2개일 때,
2가지 구조 모두 가능
*그 중 더 안정한게 major
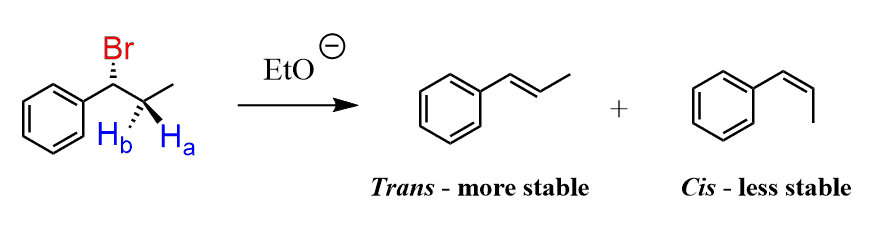
★stereospecificity
그 베타탄소 자리에 수소가 1개일 때,
1가지 구조만 가능
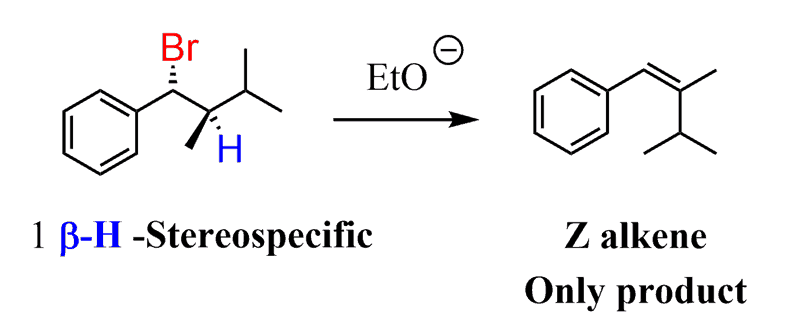
이유: anti-periplanar
H와 X가 anti & 평면상에 위치해야 반응이 일어나기 때문이다.
이때 같은 방향(wedge끼리, dash끼리)인 작용기끼리 alkene에서 같은 방향에 위치하게 됨
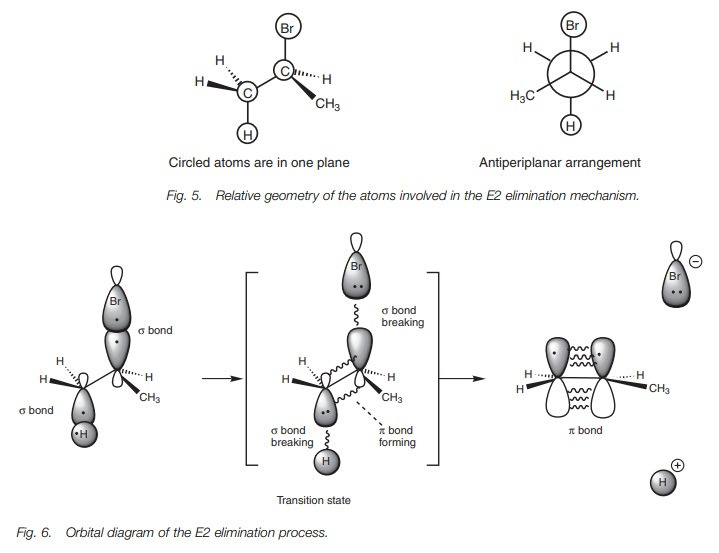
syn-periplanar이 안되는 이유는: eclipsed 형태이기 때문에 불안정해서 안 일어남
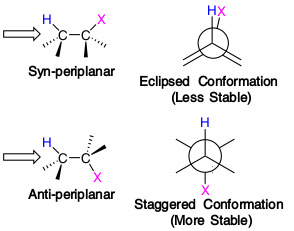
그래서 cyclohexane에서도, anti-periplanar해야 하니
up-down이 다른 H여야 반응이 일어날 수 있다.
E1
0. 메커니즘과 반응속도

할로젠 이탈기가 이탈되어 탄소 양이온이 된 후,
베타 탄소 자리의 양성자를 염기가 공격해 2중결합을 이룸 (알켄)
순차적으로 일어남
따라서 반응속도는 v=k[substrate]
일단 탄소양이온이 되어야 염기가 공격을 하기 때문이다
1. substrate
allyl benzyl > 3차 > 2차 > 1차 일수록 유리히다.
탄소양이온이 되기 좋기 때문이다.
그냥 1차는 SN1 못 일어남 (allyl, benzy 1차는 가능)
2. base
약한 염기여야 한다
이탈기가 이탈되어 탄소양이온이 되기 전에, 염기가 먼저 공격하면 E2이기 때문이다
H2O, EtOH, MeOH 등...
>> 보면 SN1에서의 약한 친핵체와 같다.
친핵체로 작용하면 SN1, 염기로 작용하면 E1이 된다.
따라서 E1, SN1은 보통 동시에 일어난다.

4. 구조의 변화
★regioselective
E2와 마찬가지로 여러 서로 다른 베타탄소 자리가 있을 수 있다.
이때 모두 반응이 가능하지만, 가장 많은 반응물을 만드는 major 베타탄소 자리가 있을 것이다
단, E1은 큰 염기든 작은 염기든 무조건 Zaitsev가 major다.
★ stereoselective는 항상 selective다.
어차피 탄소양이온을 거치기 때문이다.
※rearrangement 주의
탄소양이온을 거치기 때문에, SN1처럼 rearrangement에 주의해야 한다.
- benzyl allyl > 3 > 2 > 1 가능할 경우
- 작은 고리가 큰 고리 될 경우
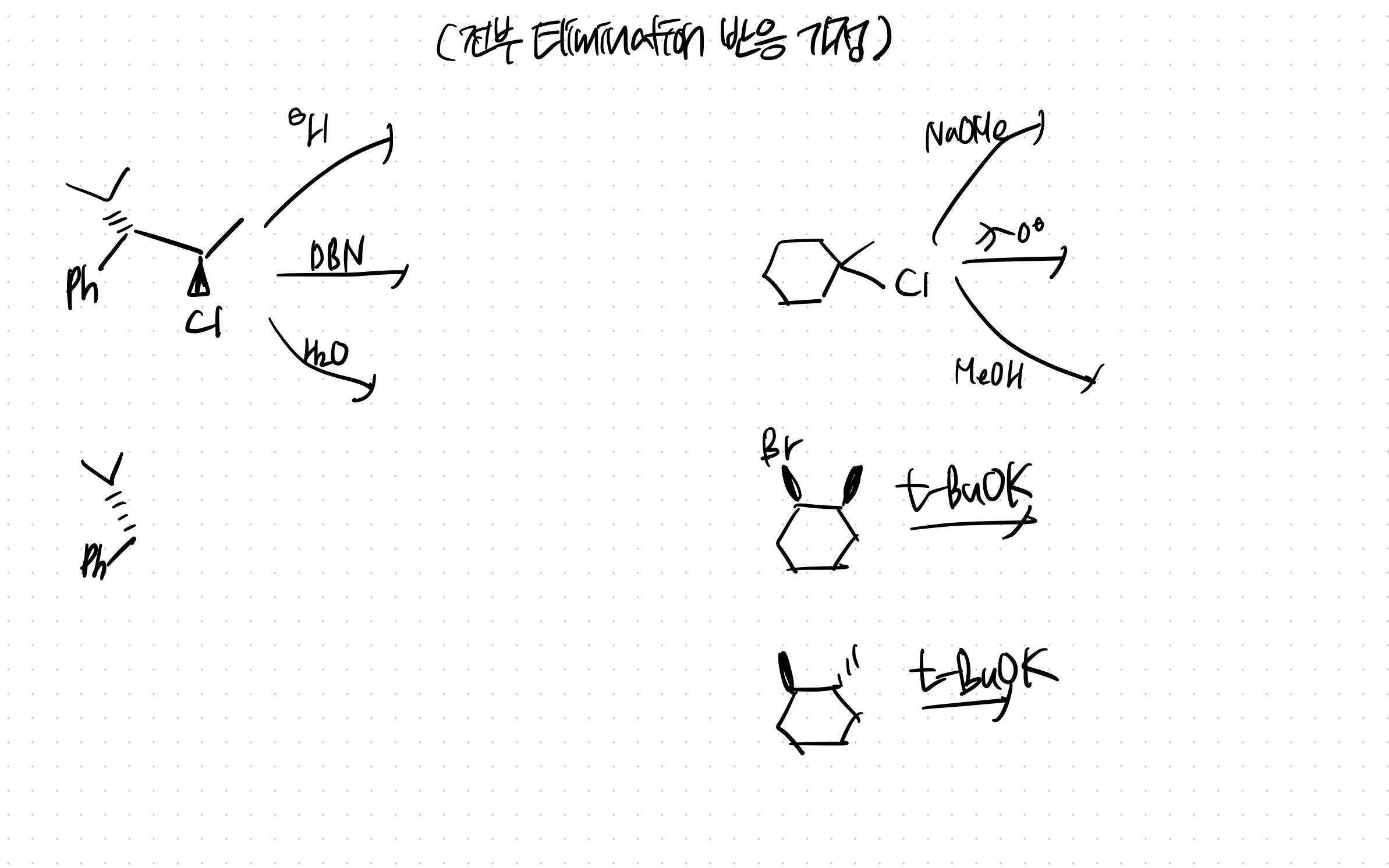
~E2, E1 구조 예측 연습~
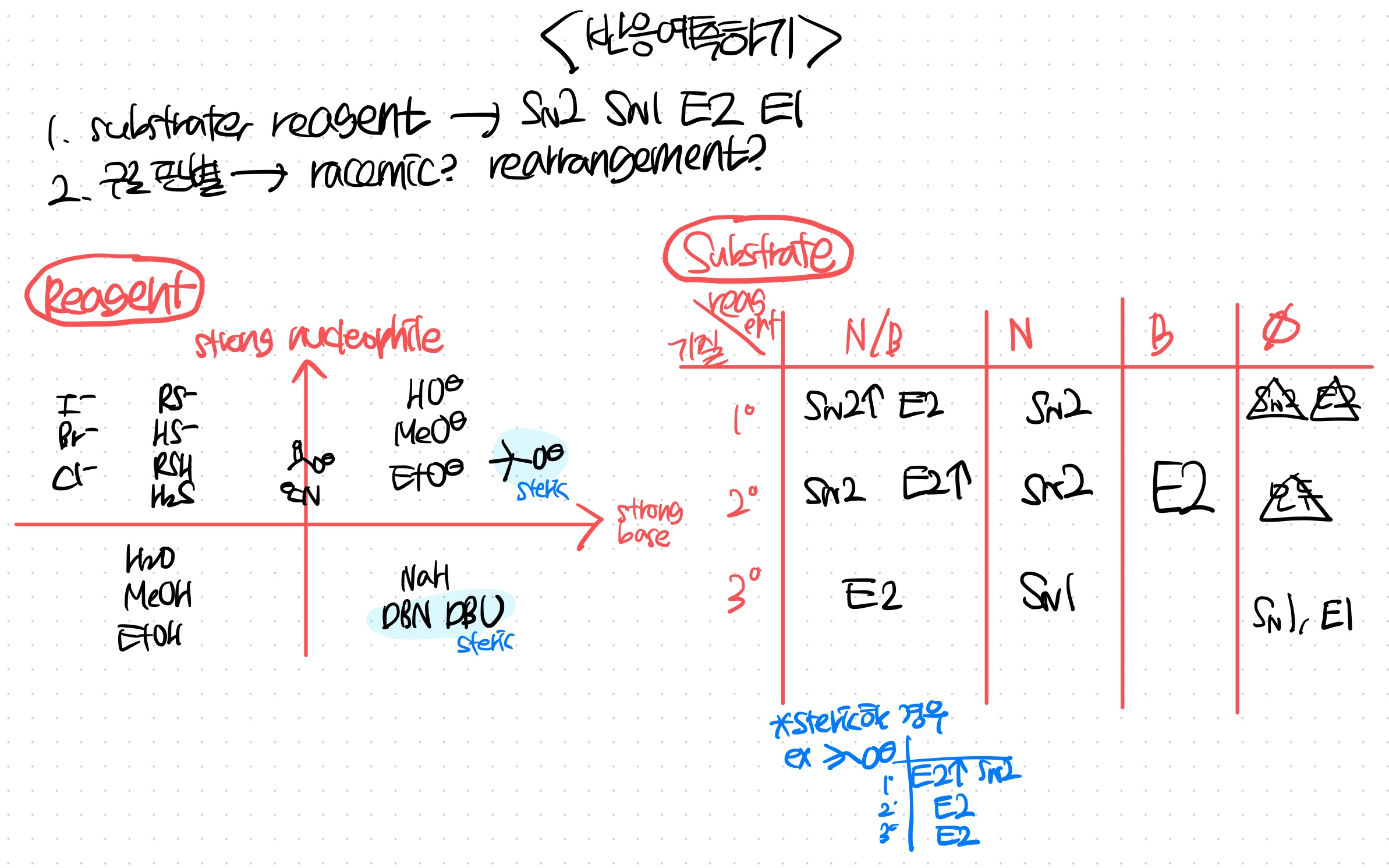
SN2 SN1 E2 E1 예측하기
1. reagent가 base인지 nucleophile인지 체크
2. substrate를 파악
3. SN2 SN1 E2 E1 중 뭐가 일어날지 체크
4. 구조까지 고려
(연습)
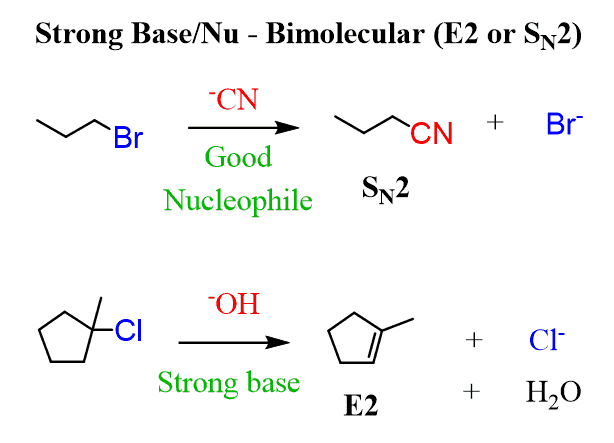
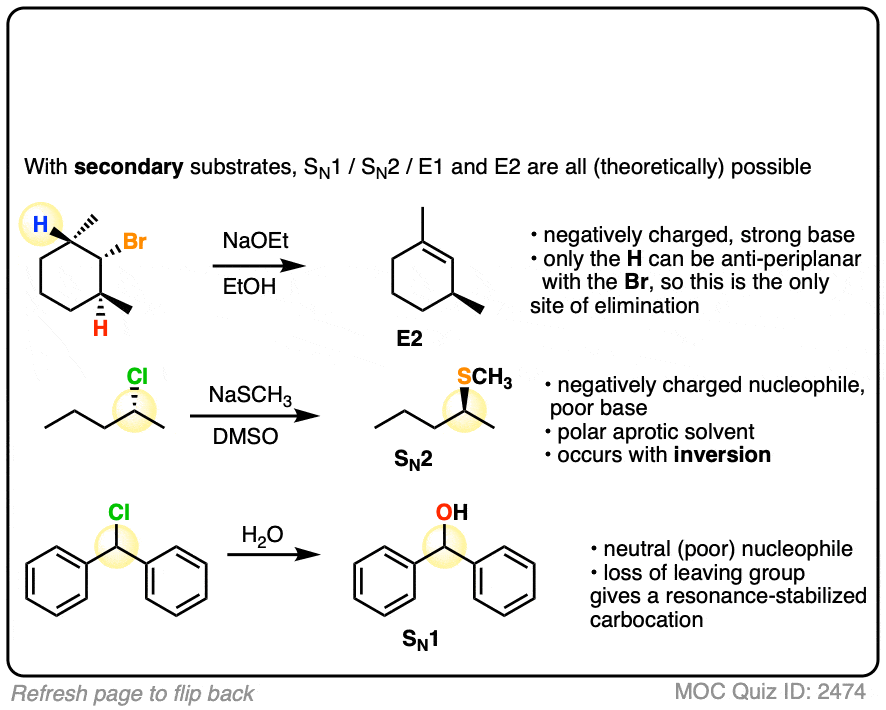
위 반응: 강한친핵체 + 1차: SN2
아래 반응: 강한염기&친핵체 + 3차: E2, 작은 염기니까 Zaitsev

위: 강한염기&친핵체 + 2차: E2우세, SN2도 일어님
아래: 강한친핵체(+염기로도 작용) + 2차: SN2 우세
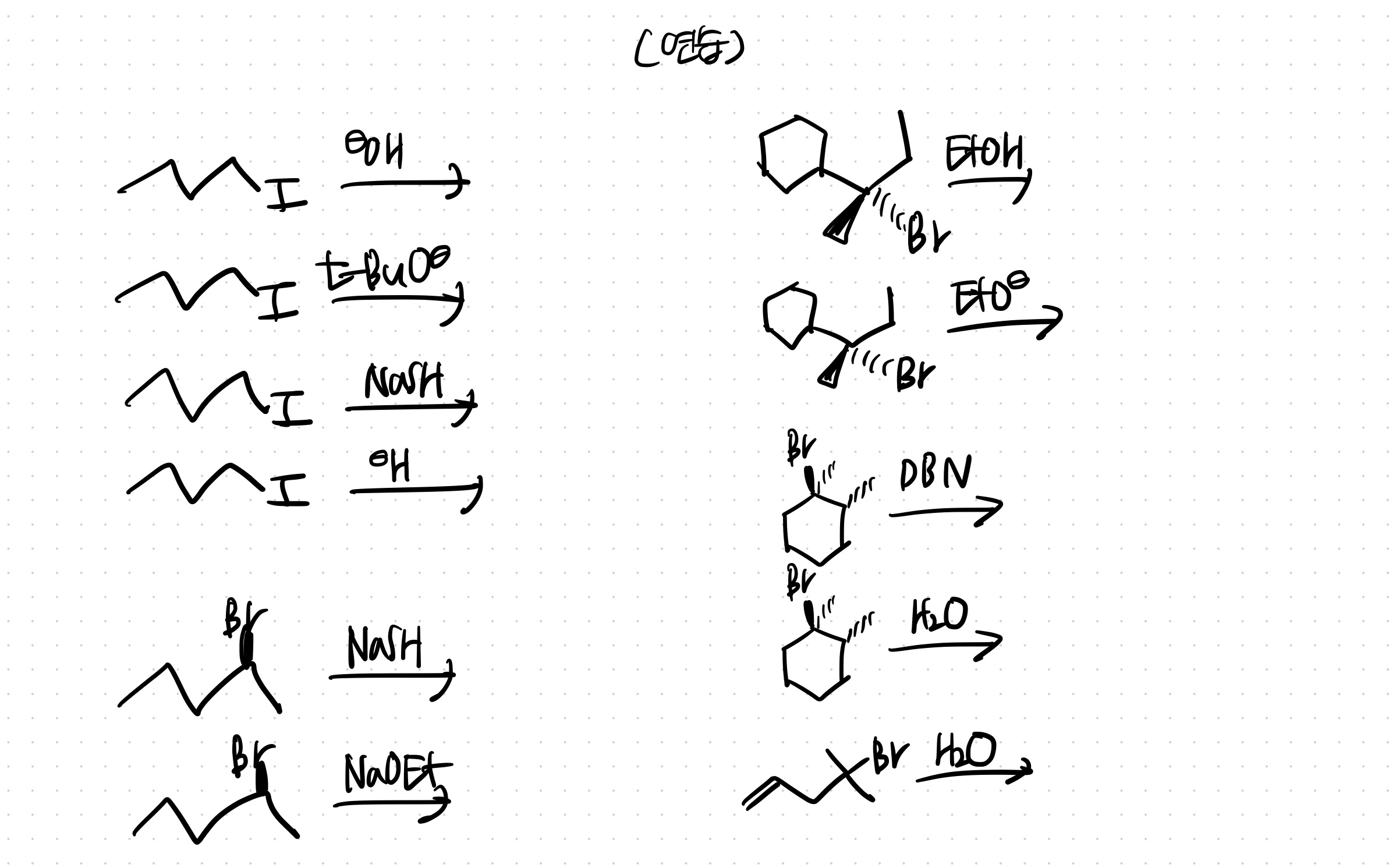
위: 2차, 강염&친 -> E2우세, stereoselective (SN2도 일어나는데 생략)
중간: 2차, 강친(+염) -> SN2우세, 구조의 inversion
아래: 2차이지만 benzyl이라 3차보다도 잘 이탈됨, 약한 염기이자 친핵체 -> SN1, E1 둘 다 가능한데 베타탄소자리에 H가 없어서 SN1만 일어남. racemic
~통합 연습~
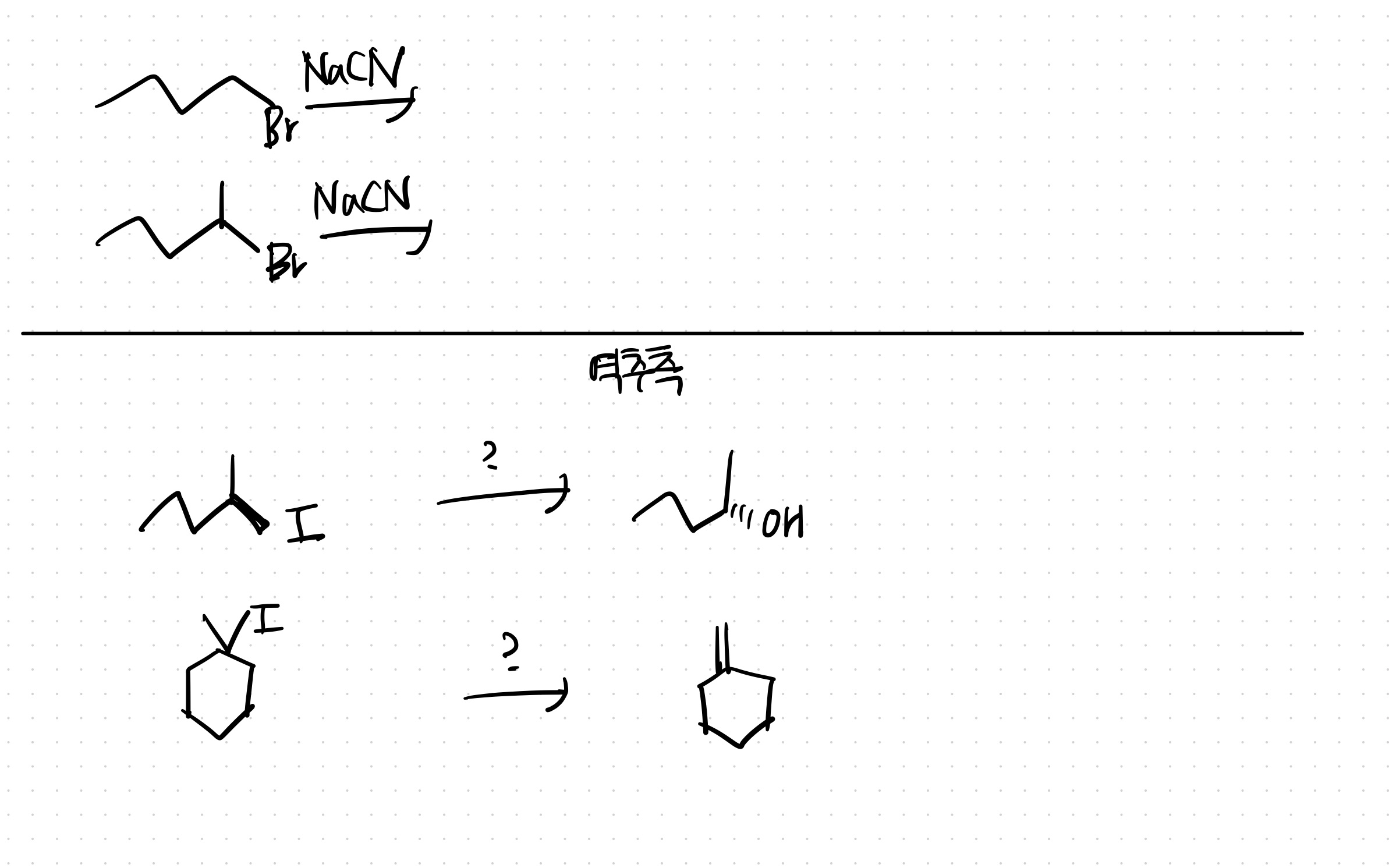
특이한 작용기: OH기가 이탈기일 때
OH기는 좋은 이탈기가 아니기 때문에 먼저 좋은 이탈기로 만들어 주어야 한다.
(뿐만 아니라 친핵체, 염기가 OH기와 반응할 수 있기 때문에..)
| 산성 용액에 넣기 (ex. H2SO4) | TsCl, py를 이용 |
 |
 |
| H2O+기가 되어 좋은 이탈기가 된다 | OTs기가 되어 좋은 이탈기가 된다 **특이점은, configuration이 유지되어 바뀐다는 점이다!! 이걸 합성과정에 이용하기 좋음 |
| 주의점!! 산성용액을 이용할 때는, E2를 위해 강한 염기를 사용할 수 없다. 알파탄소자리 대신 H2O+나 산성용액과 반응하기 떄문이다. |
산성용액을 이용할 떄 SN2 SN1 E2 E1
| SN2 | SN1 | E2 | E1 |
| 1차 OH기 + HNuc(HCl 등) | 2,3차 OH기 + HNuc(HCl 등) | 1차 OH기 + 산성용액 | 2,3차 OH기 산성용액 |
 |
 |
 |
 |
| rearrangement 주의 | rearrangement 주의 | ||
| 1차 H2O+가 먼저 이탈되지 않아, 친핵체가 공격하기까지 기다리는 셈 | H2O+는 좋은 이탈기라 2차에서 SN1이 유리 | 주의점!! 산성용액을 이용할 때는, E2를 위해 강한 염기를 사용할 수 없다. 알파탄소자리 대신 H2O+나 산성용액과 반응하기 떄문이다. 1차 H2O+가 먼저 이탈되지 않아, 염기가 공격하기까지 기다리는 셈 |
H2O+는 좋은 이탈기라 2차에서 SN1이 유리 |
| H2O+가 이탈되어 생기는 H2O가 염기로 작용 | H2O+가 이탈되어 생기는 H2O가 염기로 작용 | ||
| SN1 고려 안하는 이유? 어차피 H2O가 친핵체면 처음의 화합물로 돌아오기 때문 |
OTs를 이용할 때는 그냥 일반적인 SN2 SN1 E2 E1을 하게 된다.
'유기화학' 카테고리의 다른 글
| [유기 화학] 8. Alkyne 첨가 반응 (0) | 2024.07.29 |
|---|---|
| [유기 화학] 7. Alkene 첨가 반응 (0) | 2024.07.25 |
| [유기 화학] 5. 합성 반응에 필요한 기본 개념 (6) | 2024.07.24 |
| [유기 화학] 4. 입체화학, 이성질체 - 구조이성질체, 입체이성질체(거울쌍이성질체, 부분입체이성질체) (2) | 2024.07.18 |
| [유기 화학] 3. 알케인 (Alkane) (2) | 2024.07.16 |




댓글